Molekylär patologi Flashcards
Vilken genetisk mutation leder till melanom?
Aktiverat BRAF (mutation)

Vad är EGFR, HER2 och RAF exempel på?
Tyrosinkinaser
Vad är en drivermutation?
En mutation som driver tumörutvecklingen och utgörs av hallmarks. Dessa hittas i de flesta patienter. Onkogener och tumörsuppressorgener är ofta påverkade av dessa mutationer
Vad står CNV för?
Copy number variations
Vad är CDX2 för markör?
En GI-markör (gastrointestinal markör)
Vad menas med mutationsbörda (mutationens belastning)?
Att tumörer med många mutationer svarar bättre på checkpointhämmare (anti-PD1) än tumörer med få mutationer. Spelar ingen roll vilken mutation det är, desto fler mutationer desto bättre effekt. Alltså är passangermutationer i tumörer här en fördel för patienten, då dessa tumörer svarar starkare på checkpointhämmarna.
Vad är karyotypering?
Ett sätt att se större amplifieringar, insertioner eller translokationer.

Vilken onkogen är ofta muterat i malignt melanom?
BRAF. Sitter downstreams RAS

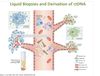
Vad är en liquid biopsi?
Man mäter ctDNA (circulating tumor DNA) från nekrotiserade och apoptoserade celler i bodplasman.

Hur kan man med blodplasma se om exempelvis en tumör försvinnut?
Man gör en liquid biopsi och mäter kända ctDNA halter.
Hur kan en tumörcell ungdå immonologisk destruktion?
Via att uttrycka PD-L1 på tumörcellen. Denna binder till en receptor på T-cellen och kommer inaktivera T-cellen och således undgå detektion.

Hur kan man med läkemedel förhindra tumörcellens resistans mot immunologiskt destruktion?
Genom att ge checkpointhämmare. Dessa kommer att hämma PD-L1 och PD-1 och förhindra inaktivering av T-cellen.

Var sitter ofta mutationer i protoonkogener som ger upphov till neoplasier?
Mutationer som aktiverar protoonkogener i så kallade hotspots. Detta är på grund av att det är svårt att aktivera en gen och det måste göras på specifika ställen.
IDH1 och PIK3CA i bilden

Var sitter ofta mutationer i tumörsuppressorgener som ger upphov till neoplasier?
Kan sitta lite var stans på genen, då dessa mutationer enbart behöver störa genens funktion (RB1 och VHL på bilden). Inte lika specifik lokalisation som onkogener.

Varför fungerar checkpointshämmare bättre på neoplasier med många mutationer?
Dessa neoplasitiska cellerna är lättare att upptäcka då de presenterar såpas många kroppsfrämande antigen. När man då förhindrar tumörens förmåga att undgå immunförsvaret kommer tumörcellen att lättare detekteras.
Vilken tumörtyp har flest mutationer?
De som utsätts för miljöfaktorer som UV-strålning, luftföroreningar och diet. Detta då tumörerna ofta uppkommer senare i livet då många mutationer har ansamlats.
Vad är targeted sequencing (panelsekvensering)?
Man väljer points of interest i genomet att sekvensera
Vad kan hända om man behandlar en tumör med ett specifikt läkemedel som tyrosinkinashämmare?
Tumören kan utveckla resistens mot denna.
Ge exempel på några behandingsprediktiva analyser samt tolkning på dessa analyser?

Genteiska mutationer kan vara av många olika typer och olika storlek. Ge några exempel!
- Genetiska mutationer:
- Translokationer
- Deletioner
- Amplifikationer
- SBS = punktmutationer
- Indels = insertioner

Vilka större avvikelser kan förekomma hos kromosomer?
- Fusioner
- Deletioner
- Duplikationer
- CNV (copy number variations) – för lite eller för många exemplarer
Vilka små genetiska förändringar kan förekomma hos kromosomer?
- Punktmutationer
- Indels (inseritoner / deletioner)
Hur sker fusion inom en kromosom ?
I detta fall sker inte fusion i form av translikation, att delar av olika kromosomer byter plats med varandra, utan fusionen skett inom en kromosom. T.ex. ALK genen transkriberar från 5’ till 3’ och EML4 genen transkriberar från 3’ till 5’. Området mellan dessa två gener kan flipflopa 180 grader vilket leder till att ALK genen kan få en del av EML4 och EML4 genen kan få delar av ALK. På FISH bilden kan man se att avståndet mellan röd och grön blivit längre som säger att det har skett något brott i kromosomens ALK gen

Vad består fusiongener av och hur viktig är dessa hos tumörer samt vilka typer av fusionsproteiner oftast behandas?
Fusionsgener består oftast av två olika delar och är starkt drivande i tumörer. De fusionsproteiner som oftast behandlingen riktas mot är de fusionsproteiner som innehåller tyrosinkinasdomäner. Många fusionproteiner innehåller inte tyrosinkinasdomän