Zytostatika Flashcards
Erkläre die unterschiedlichen Therapieansätze bei Tumorerkrankungen
kurative Therapie: chirurgische Entfernung, Strahlentherapie und Chemo die zusammen zur Heilung führen
palliative Therapie: bei metastasierenden Neoplasien, Beschwerden lindern und Lebenszeit verlängern
allgemeine Chemotherapie: primär bei disseminierten Tumoren (Leukämien) und bei Metastasen
adjuvante Chemo: nach der OP oder nach Bestrahlung
neoadjuvante Therapie: vor OP um Tumor zu verkleinern vor dem EIngriff
Welche Gruppen von Zytostatika werden unterschieden?
Phasenspezifische Zytostatika
-> sind nur in bestimmten Phasen wirksam
Phasenunspezifische Zytostatika
-> wirken während des gesamten Zellzyklus
Wodrauf zielen zytotoxische Chemotherapeutika ab?
zytotoxische Chemotherapeutika zielen auf die hohe Teiungsrate der Tumorzellen ab
Eingegriffen wird in verschiedenen Phasen des Zellzyklus
Therapie ist immer eine vollständige Elimination aller Tumorzellen (Ansonsten Rezidivgefahr)

Erkläre die Kinetik des Tumorwachstums
Generationszeit:
Due Zeit, die eine Zelle zum Durchlaufen eines Zellzyklus braucht
Wachstumsfraktion:
Verhälnis der Zahl der sich teilenden Zellen zu der Gesamtzahl der Zellen eines Tumors
Volumenverdopplungszeit:
Zeit, um die Tumorgröße zu verdoppeln
-> je kürzer diese Zeit, desto Wirksamer sind konventionelle Chemotherapeutika
Gompertz-Kinetik:
zu Beginn: viele Zellen im Zellzyklus = Wachstumsfraktion ist hoch
zunehmend wird dann die Wachstumsfraktion kleiner = Wachstumskurve flacht ab
Viele Krebszellen treten dann in G0-Phase ein! -> in der G0-Phase sind viele konventionelle Chemos wenig wirksam

Neue “targeted Therapy”
Was sind Ziele dieser neuen antineoplastischen Therapie
Eingriff in die SIgnaltransduktion der Tumorzellen, der am Tumorwwachstum beteiligten Zellen bzw. in Interaktion zwischen Zellen
mit kleinen Molekülen
mit Antikörpern
mit CAR-T-Zellen = modifizierte T-Zellen mit chimärem Antigenrezeptor (CAR) gegen CD19 (auf Oberflächen von B-Zellen)
Welche Zytostatika greifen in die Biosynthese der Nukleinsäuren ein?
Hydroxyharnstoffe:
Hemmen die Reduktion von Cytidyl- zu Deoxycytidyl-Säure
-> Hemmung der Pyrimidin Synthese
Cytosinarabinosid:
Hemmung der DNA-polymerase a
Methotrexat:
Hemmung der Folsäure-Reduktion = Hemmung der Methylierung von Deoxyuridyl zu Thymidyl-Säure
-> Hemmung der Purin-Biosynthese
5-Fluorouracil:
Hemmung der Thymidylat Synthese
6-Mercaptopurin / 6-Thioguanin:
-> Hemmung der Purinbiosynthese
Erkläre die long-cell-kill-Hypothese
gleixhe Dosis eines Zytostatikums oder einer Kombination tötet die konstante Fraktion der Tumorzellen ab
= mit fortschreitender Chemo gleicher Intensität wird also die absolute Zahl der abgetöteten Zellen immer kleiner
gilt nur dann wenn:
der gleiche ANteil der Tumorzellen sich teilt
alle Krebszellen gegen das Zytostatikum gleich empfindlich sind
Während der therapie keine Resistanzen entwickelt werden

Nenne die wichtigsten Mechanismen der Resistenzentwicklung
Allgemein:
Tumorzellen teilen sich häufiger = 1. Grund für Resistenzentwicklung
Durch Chemotherapie kommt es zu Selektion der Resistenten Zellen = 2. Grund für Resistenzentwicklung / Bestand der Resistenten Zellen
Mechanismen:
- > verminderte Aufnahme des Chemotherapeutikums (bei Cytarabin oder Methotrexat)
- > verminderte Metabolisierung zum eigentlichen Wirkstoff (Cytarabin, 5-Fluoruracil, Methotrexat, Mercaptopurin, Tioguanin)
- > beschleunigte Inaktivierung (bei Alkylanzien, Anthrazyklinen)
- > veränderte Affinität zu den Zielmolekylen (bei Topoisomerase-II-Hemmstoffen)
- > Überexpression der Zielproteine durch Geamplifikation (Beispiel: Überexpression von Dihydrofolsäure-Reduktase bei Methotrexat-Therapie)
- > effektivere Reparatur von DNA-Schäden
- > verstärkte Ausschläusung von Zytostatika aus der Zelle

Welche Gewebe sind vn den Nebenwirkungen der Chemotherapie besonders betroffe
Gewebe mit einer hohen Teilungsrate
Haarfollikel -> Haarausfall
Darmschleimhaut / Schleimhaut des GIT
Blutzellen/Knochenmark
Spermatogonien in den Testes
Nenne einige sofortige/ frühe und späte Nebenwirkungen von Zytostatika
Sofortreaktionen = innerhalb von Stunden
Früh = innerhalb mehrerer Tage
Spät = nach mehreren Wochen
Sofortreaktionen:
Übelkeit, Erbrechen, allergische Reaktion, Fieber, RR-Abfall
Früh:
Knochenmarksuppression, Immunsuppression, Schleimhautschäden, Haarausfall
verzögerte/spät:
Anämie, Leukopenie, Kardiomyopathie, Polyneuropathie, Azoospermiem Wachstumshemmung bei Kindern, Induktion von Zweittumoren

Erkläre die Wirkprinzipien von
Antimetaboliten
Folsäure-Analoga, Purin-Analoga, Pyrimidin-Analoga
= inhibieren die Synthese von Purin / Pyrimidinnukleotiden
-> sind phasenspezifische Zytostatika und entfalten ihre Wirkung in der S-Phase
Folsäure-Analoga
Nenne Wirkmehanismus, Vertreter, Indikation, Nebenwirkungen
Vertreter:
Methotrexat
Wirkmechanismus:
Hemmstoffe der Dihydrofolsäure-Reduktase
- > wird in die Zelle aufgenommen und dann durch einen Polyglutamatrest in der Zelle fixiert = es akkumuliert in der Zelle
- > es hemmt fast irreversibel die Dihydrofolsäure-Reduktase
- > verhindert Überführung der Dihydrofolsäure in die wirksame Tetrahydrofolsäure (u.a. C1-Donor in der Purinsynthese)
WICHTIG: bei lebensbedrohlichen Nebenwirkungen muss direkt Folinsäure (Tetrahydrofolsäure) zugeführt werden, da normale Folsäure nicht wirksam ist weil sie nicht umgesetzt werden kann
Indikation:
viele Tumorarten
Nebenwirkungen:
interstitiele Pnuemonie, Mukositis, Nierentoxisch, Lebertoxisch
Erkläre die Wirkprinzipien von
Hydroxyharnstoffen
hemmen die Ribonukleotidreduktase, welche Ribonukleotide in Desoxyribonukleotide umwandelt
Erkläre die Wirkprinzipien von
Alkylierenden Zytostatika
Nenne die wichtigsten Vertreter
Stickstoff-lost-Verbindungen, Platin-Analoga
-> bilden Addukte mit der DNA = Alkylieren diese
= heften kovalent Aklylreste an nukleophile Gruppen der DNA, RNA und an Proteine
Stickstoff-Lost-Verbindungen:
Lost = Hautschädigender Kampfstoff - nach Lommel und Steinkopf benannt
die Moleküle beihalten 2-Chlorethylgruppen -> Nach Eintritt in die Zelle wird das Chloratom abgespalten -> der Rest der Seitenkette bindet hochreaktiv an nukleophile Gruppen
-> die DNA wird kovalent Quervernetzt = Cross-links (Intrastrang und Interstrang Quervernetzungen) = Fehler beim Ablese und Strangbrüche sind induziert
häufig Bindung an N7-Position des Guanins
sind während des gesamten Zellzyklus Zytotoxisch
Wirkstoffe: “famide”
Cyclophosphamid
Ifosfamid
Trofosfamid
Hydrazine:
Temozolomid
Platin-Haltige Substanzen:
Cisplatin, Carboplatin

Nenne die Toxizität des Cyclophosphamid (als Beispiel für Alkylierende Zytostatika)
Wie kann eine hämorrhagische Zystitis verhindert werden?
- > Übelkeit/ Erbrechen und Haarausfall (reversibel) bei hohen Dosen
- > Hemmung der Granulopoese, Thrombopoese, Erythropoese = Knochenmarksuppression
- > kanzerogen, teratogen (Fehlbildungen verursachend), mutagen
- > Amenorrhoe, Azoospermie
- > Pneumonie
- > Myokardtoxisch
-> hämorrhagische Cystitis -> durch abgespaltenes Acrolein - verhindert durch Zusatzbehandlung mit MESNA (2-Mercaptoethansulfonat-Na) - bildet mit Acrolein stabiles nicht toxisches Kondensationsprodukt
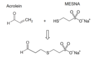
Ekläre den Metabolismus des Cyclophosphamid
1. Appiziert wird Cyclophosphamid
2. in der Leber enzymatische aktiviert (CYP3A, 2B6, 2C19)
- > 4-Hydroxycyclophosphamid / Aldophosphamid
3. diese werden dann in der Tumorzelle umgesetzt zu 2 Produkten:
1. Phosphorsäureamid-Lost = die eigentliche Wirkform
2. Acrolein (blasentoxisch)
Inaktivierung:
Acrolein mit zusätzlich appiziertem MESNA umgesetzt -> Detoxifizierung
4-Hydroxycyclophosphamid -> Ketocyclophosphamid
Aldophosphamid -> Carboxyphosphamid

Nenne die Indikationen für Cyclophosphamid
Remissionsinduktion und Konsolidierungsphase bei akuter lymphatischer Leukämie
Remissionsinduktion bei Morbus Hodgkin
Non-Hodgkin-Lymphome
CLL nach Versagen der Standardtherapie (Chlorambucil/Prednison)
Remissionsinduktion bei Plasmozytom
Mammakarzinom (palliativ), Ovarialkarzinom, kleinzelliges Bronchialkarzinom, Neuroblastom, Osteosarkom
Erkläre die Wirkprinzipien von
Zytostatisch wirksamen Antibiotika
Interkalierende Antibiotika, Anthrazykline oder Bleomycin
zytostatische Wirkung durch
-> Interkalation Einschieben von Molekülen in die Doppelhelix zwischen zwei Basenpaare (Aktinomycin, Anthrazykline, Beleomycin)
= Hemmung der Transkription und Replikation, unabhängig vom Zellzyklus
- > durch Produktion von Superoxid-Radikalanionen (Anthrazykline, Bleomycin)
- > wirken als Alkylanzien - Alkylierung der DNA (Mitomycin)
Anthrazykline
Nenne den wichtigsten Vertreter und nenne dazu:
Wirkmechanismus
Indikation
Nebenwirkungen/Toxizität
Dosis
Vertreter:
Doxorubicin (DNR) (weitere: Epirubicin, Idarubicin)
/ eine der wichtigsten Gruppen der zytostatischen Substanzen
Wirkmechanismus:
bestehen aus tetrazyklischem Chromophor und einem Aminozucker
mehrere zytotoxische Wirkungen:
- Interkalation
- Hemmung der DNA und RNA-Polymerase
- Hemmung Helicase und Topoisomerase
- es können Radikalreaktionen ausgelöst werden -> Alkylierung der DNA
- Bildung von Superoxid-Radikalanionen -> wenn diese metabolisiert und inaktiviert werden entstehen Hydroxyl-Radikale = machen Einzel und Doppelstrang-Brüche
Indikation:
- > Mamma-CA
- > rezidivierendes Ovarial-CA
- > metastasierendes Harnblasen-CA
…
Nebenwirkungen:
Dosislimitierend sind Knochenmarksuppresion und Kardiomyopathie (entweder durch Mitochondrienschädigung oder der durch die Bildung von ROS)
- > Übelkeit/Erbrechen
- > reversibler Haarausfall
- > lokale Nekrose bei Paravasat
- > hämorrhagische Zystitis
Dosis:
Einzeldosis: 30-75m/m2 i.v - Wiederholung nach 3 Wochen
Wie kann man die Kardiotoxizität durch Doxorubizin vermeiden?
Gesamtdosis begrenzen:
Dosen auf unter 450-550mg/m2 begrenzen
Kontrolle der ejektions fraktion mit UKG und Radionukleotid-Angiographie
Erkläre die Wirkprinzipien von
Topoisomerase I und II
hemmen Enzyme, die für den Normalen Verlauf der Transkription und Replikation essentiell sind
Grundlage: bei DNA-Replikation in der Synthesephase ist DNA-Doppelhelix vor der Replikationsgabel sehr stark verdrillt =Overcoiling
-> die DNA-Polymerase kann dann den Tochterstrank nicht synthetisieren
Topoisomerase I = induziert einen Bruch des EInzelstrangs und die Doppelhelix kann sich entspannen
Topoisomerase II = spaltet den Doppelstrang und ein benachbarter Doppelstrang kann die Bruchstelle passieren = korrrekte 3D-Stroktur der DNA-Doppelstränge
Nenne die wichtigsten Vertreter der Topoisomerase-Hemmstoffe
Indikation und Nebenwirkungen
Topoisomerase-I:
Topotecan, Irinotecan
Topoisomerade-II:
Etoposid, Teniposid
Indikation:
Topocetan: Ovarialkarzinom
Irinocetam: kolorektalen Karzinom
Topoisomerase-II-Hemmstoffe: akuter myeloischer Leukämie, verschiedenen soliden Tumoren
Nebenwirkungen:
unspezifische
Irinotecan: kann cholinerges Syndrom auslösen: Schwizen, Tränenfluss, Bauchkrämpfe, Hypotonie
Erkläre die Wirkprinzipien von
Vinca-Alkaloiden und Taxane
Nenne die wichtigsten Vertreter
phasenspezifische Zytostatika = interagieren mit Mikrotubuli und hemmen dadurch die Zellteilung
Vinca-Alkaloide:
binden an Tubulin und hemmen die Polymerisation von Tubulin-Molekülen zu Mikrotubuli
= dadurch kein Mikrotubuli-System und keine Mitose
Vertreter: Vinblastin
-> bei Leukämie, Lymphomen, Mamma-CA …
Taxane:
Vertreter: Paclitaxel, Docetaxel
Wirkungsweise: Wechselwirkung mit beta-Tubulin -> Ausbildung der Mikrotubuli wird gefürdert aber es entstehen Mikrotuubuli die Funnktionsunfähig sind
+ das bestehende Mikrotubuli-System wird stabilisiert = nicht genug Tubulin für Synthese von funktionsfähigen Mikrotubuli
-> bei Ovarialkarzinom, Mamma-CA, Bronchial-CA
Erkläre die Wirkungsweise von Bleomycinen
hauptsächlich Bleomycin A2 und B2
Hauptmechanismus:
Bildung von Superoxid-Radikalionen
Bleomycin bildet in der Zelle mit Fe einen Bleomycin-Fe-Komplex = dieser interkaliert in die DNA
durch Zerfall entstehen dann Hydroxyl-Radikale die Doppelstrangbrüche induzieren
Indikation:
Plattenepithelkarzinome (Kopf und Hals)
Hodentumore
Lymphome
maligne Pleuraergüsse
Nebenwirkungen:
anaphylaktische Reaktion (Schüttelfrost, Bronchospasmus, RR-Abfall)
Lungentoxizität: Dosislimitierend





