biology of the cell2 Flashcards
מה הפירוקסיזום יודע לעשות?
הפירוקסיזום הוא איברון שיודע לקיים תהליכי חמצון רבים
כיצד הפרוקסיזום שונה מהמיטוכונדריה ומהכלורופלסט?
מוקף בממברנה אחת ולא שתיים, חסר גנום עצמאי וריבוזומים
היכן מקודדים כל החלבונים של הפירוקסיזום?
בגנום הגרעיני
איך החלבונים מגיעים לפירוקסיזום?
מה-
er
איך קוראים לשני אינזיים מפורסמים שיש בפירוקסיזום?
קטאלאז ואוראט אוקסידאז.
מה יותר קדום הפירוקסיזום או המטירונדריה?
הפירוקסיזום
מה הפירוקסיזום נוהג לייצר במהלך עבודתו?
הפירוקסיזום נוהג לייצר מי חמצן
מה האינזים קאטאטלז יודע לעשות?
מנצל את מי החמצן על מנת לחמצן סובסטראטים כמו למשל חומצה פורמית, פורמאלדהיד ואלכוהול בטכניקה/מנגנון המכונה “פרוקסידציה”.
היכן חשוב לעשות פירוקסידציה?
טכניקה זו חשובה במיוחד בכליה, בעזרתה מחומצנות מולקולות רעילות ומונעת מהם להגיע לזרם הדם. כך למשל כרבע מהאלכוהול שאנו צורכים מחומצן לפורמאלדהיד בדרך זו.
איפה מתקיים חמצון בטא מלבד המיטוכנדריה?
בפירוקסיזום
היכן שמרים וצמחים עושים חמצון בטא?
בפירוקסיזום
פלזמזוגן הוא?
ואיפה הוא נוצר
פוספוליפיד נפוץ במיאלין
בפרוקסיזומים
אילו פוספוליפידים הם הנפוצים במיאלין?
פלזמלוגן
כל הפירוקסיזומים באורגניזם הם שווים בגודלם ותפקידם
לא נכון
אילו סוגי פירוקסיזומים נלמדו בצורה רחבה?
- הפרוקסיזום בעלים ושם הוא משמש לפוטורספירציה, תהליך המנצל חמצן (בניגוד לפוטוסינתזה) כנראה מהסיבה שדיברנו עליה והיא להפחית את כמות החמצן בסביבה התאית.
- בזרעי הצמחים ניתן למצוא פרוקסיזום הממיר אצטיל קו איי לסוכר במהלך רב שלבי המכונה מעגל הגליאוקסילאט, לכן פרוקסיזום מסוג מקבל את השם גליאוקסוזום. במעגל זה, 2 אצטיל קו-איי מתחברים ליצירת סוקסינאט, שאחר כך יוצא לציטוזול משמש לבניית גלוקוז.
איזה סיגנאל יש לחלבונים שעוברים מהציטוזול אל הפירוקסיזום?
סיגנאל של 3 ח”א בקצה הקרבוקסילי או בקצה האמיני
רוב החלבונים שמגיעים לפירוקסיזום מגיעים מה-
er
לא נכון הם מגיעים מהציטוזול
איך החלבונים נכנסים מהציטוזול לפירוקסיזום?
רצפטורים חלבוניים מסיסים בציטוזול, המכונים פרוקסינים, מזהים את הסיגנאל
תהליך הכניסה אל הפרוקסיזום מתווך על ידי מספר רב של פרוקסינים ומונע על ידי
ATP.
למשל, על גבי הממברנה של הפרוקסיזום ניתן למצוא 6 פרוקסינים הבונים קומפלקס גדול שמאפשר לקומפלקסים אוליגומרים לעבור דרכו מבלי לאבד את המבנה המרחבי שלו.
על מנת לאפשר לקומפלקסים לעבור תוך שימור המבנה שלהם, הוא חייב להתאים את הצאו למימדים שלהם ולכן מעריכים שהקומפלקס מתאים את עצמו למידותיהם של העוברים דרכו.
מה הוא שימוש ב-
סי טרמינאלי?
החלבון
Pex5
מזהה את הסיגנאל ומלווה את החלבון מהציטוזול אל הפרוקסיזום. על מנת לצאת החוצה לציטוזול מחדש, החלבון Pex5
עובר יוביקוויטילציה, שם מוסרת היוביקוויטילציה על
pex5
שני פרוקסינים נוספים,
Pex1 ו Pex6
מתארגנים ביחד למבנה של
ATPase
שעוזר לקצור את ה-
ATP
הנדרש להוצאת
Pex5
מהפרוקסיזום בחזרה אל הציטוזול.
.
zwellenger syndrome?
תסמונת מולדת בה ישנה פגיעה קשה בשלמות בפרקוסיזום או בהעברת חלבונים לפרוקסיזום. למשל חוסר ב-
pex5
גורם לפרוקסיזומים ריקים. מוטציה ב-
pex7
שאחראי לזיהוי הסיגנאל האמיני (הפחות נפוץ) גורם למחלה קלה יותר.האיברים המושפעים כוללים מוח, כבד, כליות והילדים מתאים זמן קצר לאחר הלידה.
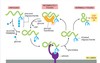
כיצד נוצרים הפירוקסיזומים?
מרבית הפרוקסיזומים נוצרים מהנצה של ממברנה מפרוקסיזום קודם. עם זאת, לעיתים פרוקסיזומים נוצרים מהנצה של וזיקולות מה-
ER
עובדה שחושפת דרך נוספת בה מגיעים חלבונים אל הפרוקסיזום. מה-
ER
מתרוממות ווסיקולות המכונות
Peroxisomal precursor vessicles, בתוכם יש חלבונים פרוקסיזומאלים.
במה פירוקסיזומים צריכים להיות מלווים כאשר הם מניצים מה-
er?
pex 3 and pex 15
לרוב גם עם
Pex 19
איך הפירוקסיזומים משיגים ממברנות?
אם אמרנו שפרוקסיזומים יכולים לשכפל את עצמם על ידי הנצה, כיצד הם משיגים ממברנות? המחשבה היא שגם הליפידים מועברים אל תוך הפרוקסיזום, למרות שחלק מהממברנות כנראה מגיעות מה-
ER.
מה זה ה-
er?
רשתית תלת מימדית של ממברנות, התוך הממברנה מצוי חלל שבו מתרחשים תהליכים חשובים