Métabolisme protéines et acides aminés Flashcards
Lors du métabolisme des macromolécules, que finissent par devenir les protéines, les polysaccharides et les lipides?
De l’acétyl-CoA, qui intervient ensuite dans le cycle de Krebs

Combien compte-t-on d’acides aminés différents dans la nature? Et combien sont protéinogéniques et présents chez les vertébrés?
500-600 (540 environ) dans la nature.
20 protéinogéniques et chez les vertébrés.
Quelles sont les 3 composantes de l’acide aminé?
- Acide carboxylique (-COOH)
- Fonction amine (-NH2)
- Chaine latérale variable (-R)
Qu’est ce qui est à l’origine de la différence entre les acides aminés, et quel est l’effet de cette différence?
La nature chimique de la chaine latérale, qui, par sa composition, confère des caractéristiques physico-chimiques précises.
Quelles sont les 2 formes d’un acide aminé?
Non-ionisée et ionisée

Donnez 5 exemples de caractéristiques possibles de la chaîne latérale de l’acide aminé
- Aliphatique
- Hydroxylé
- Contenant du soufre
- Diacide
- Aromatique
- Autres
V ou F? La plupart des acides aminés sont solubles dans l’eau parce que la plupart des acides aminés sont hydrophiles
Vrai
Quels acides aminés sont moins hydrophiles? Dans quoi sont-ils plus solubles?
Ceux avec une longue chaîne carbonée ( leucine, isoleucine, phénylalanine et tyrosine)
Ils sont plus solubles dans les solvants organiques (hydrophobes)
Que détermine la solubilité d’un acide aminé?
- Son pouvoir d’incorporation dans les divers tissus et organes
- La structure et la fonction des protéines
De quoi dépend la polarité des acides aminés?
De la présence d’un groupement chargé ou non sur la chaine latérale
Donnez des exemples de groupements chargés qui rendent un acide aminé polaire
-OH (hydroxyle), SH (thiol), COO-, N-
À quoi participent les groupements chargés des acides aminés polaires?
Des liaisons hydrogènes ou ioniques (ou autre)
Que confèrent les acides aminés polaires aux protéines qu’ils constituent?
- Une solubilité dans l’eau
- La formation de domaines peptidiques qui ont des fonctions biochimiques importantes, enzymatiques, immunologiques, hormonales et autre
Vrai ou faux? La chaine latérale des acides aminés non polaires participe généralement à des liaisons hydrogène ou ionique
Faux, au contraire.
Que confère l’enchainement d’acides aminés hydrophobes à la protéine? Qu’est ce que cela influence surtout?
Une hydrophobicité.
La structure 3D de la protéine
V ou F? Les acides aminés sont des acides forts et des amines forts.
Faux, ce sont des acides faibles et des amines faibles.
Quelle est la formule chimique selon laquelle se dissocient les acides aminés?
HA est la forme acide non dissociée. H+ et A- représentent les produits ionisés qui sont le proton H+ et la base conjugée A-

Qu’arrive-t-il à la réaction de dissociation plus le Ka est grand?
Plus la réaction est déplacée vers la droite et plus la forme HA est convertie vers les autres formes (H+ et A-).
Qu’est ce qui détermine la concentration du milieu?
La concentration en ion H+
Comment calcule-t-on le pKa à partir de Ka?
pKa=-logKa
Comment calcule-t-on le pH à partir de la concentration en H+?
pH=-log[H+]
C’est quoi l’équation d’Henderson-Hasselbach et qu’est ce qu’elle exprime?
pH = pKa + log [A-]/[HA]
Elle exprime la relation entre le pH du milieu et les concentrations de HA et A-
Pour un acide aminé, qu’est ce qui varie parmi les propriétés suivantes:
- le pKa
- les concentrations des différentes formes (I, II, III)
- le pH de la solution
Pour un acide aminé, le pKa est fixe mais les concentrations des formes I , II et III varient selon le pH de la solution.
L’inverse est vrai aussi , le pH de la solution variera selon les concentrations des formes I , II et III]

Combien de fonctions acide ou de fonctions amine peut contenir un acide aminé?
Un ou plusieurs acide et un ou plusieurs amine
À quoi correspond chacune des fonctions acide ou amine des acides aminés?
À un pK caractéristique
C’est quoi le point isoélectrique d’un acide aminé?
pH à laquelle la charge nette de la molécule est égale à 0. À ce point, l’acide aminé a des charges positives et négatives qui sont égales
Qu’est ce qui est à son maximum lorsque le pH de la solution correspond au pKa d’un acide aminé?
Le pouvoir tampon d’une solution

À quoi correspondent les pK en termes de concentrations des différentes formes d’un acide aminé?
C’est quand [I]=[II] ou quand [II]=[III]

Donnez un example de tampon constitué d’un ion
Le tampon bicarbonate

Donnez deux exemples physiologiques des solutions tampon
Le tampon bicarbonate et l’absorption des médicaments

Quelle est la provenance des acides aminés formant le pool sanguin d’acides aminés? (3)
- Acides aminés nouvellement synthétisés par le corps
- Acides aminés provenant de la dégradation des protéines alimentaires
- Acides aminés provenant de la dégradation des protéines endogènes (catabolisme protéique)
La majeure partie des acides aminés sont utilisés pour quoi?
La synthèse protéique
Quels sont les rôles mineurs des acides aminés, autres que la synthèse de protéines?
- Faible source d’énergie
- Une minorité (30g) forme les produits spécialisés tels que:
- les porphyrines
- les purines
- les pyrimidines
- la créatine
- les neurotransmetteurs
- autres
Vrai ou faux? Les acides aminés peuvent être stockés, tout comme les lipides et les glucides.
Faux. Contrairement aux lipides et aux glucides, ils sont soit utilisés par le corps, soit éliminés après leurs dégradations.
Quelles sont les deux étapes du catabolisme des acides aminés?
- Catabolisme de la fonction amine des a.a. (déamination)
- Catabolisme de la chaîne carbonnée des a.a.
Quelle est la première étape du catabolisme des acides aminés? Quel est le nom de la réaction?
Transfert du groupement amine, via la déamination par transfert d’amine.
Quelle est la deuxième étape du catabolisme des acides aminés?
La désamination oxydative
À quoi est transféré le groupe amine lors de la désamination par transfert d’amine? Quel est un autre nom pour désigner cette étape?
Le groupe amine (NH3+) est transféré au cétoglutarate
Cette étape s’appelle aussi transamination.
Quels sont les produits de la désamination par transfert d’amine?
Un céto-acide et un glutamate.

Qu’est ce qui peut arriver au glutamate produit par la désamination par transfert d’amine?
Cette dernière peut être désaminée par la suite, par oxydation, ou peut être utilisée comme source d’amine dans la formation d’acides aminés non essentiels
Comment appelle-t-on es enzymes responsables de cette réaction de transamination?
Les aminotransférases
Que sont les aminotransférases?
Un groupe d’enzymes spécifiques. Chaque aminotransférase est spécifique à quelques acides aminés donateurs d’amines.
Quelle enzyme est présente dans la plupart des tissus?
L’alanine aminotransférase (ALT)
Que catalyse l’alanine aminotransférase (ALT)?
Est-ce que cette réaction est réversible?
Elle catalyse le transfert du groupe a-aminé de l’alanine à l’a-cétoglutarate pour former le pyruvate et le glutamate.
Oui, elle est réversible.

V ou F? Durant le catabolisme des acides aminés la réaction de la dégradation du glutamate est la plus favorisée.
Faux. Durant le catabolisme des acides aminés la réaction de la formation du glutamate est la plus favorisée.

Que fait l’enzyme aspartate aminotransférase (AST)?
Cette enzyme transfert le groupe amine du glutamate vers l’oxalo-acétate pour former l’asparate qui sera utilisée par la suite dans le cycle de l’urée et l’oxaloacétate.

C’est quoi la désamination oxydative? Qu’est ce que ça libère?
Un processus qui provoque la libération d’un groupement amine sous forme d’ammoniaque libre (NH3)

Où se produit la désamination oxydative dans le corps?
Surtout dans le foie et dans les reins
Quel est l’enzyme principal de la désamination oxydative?
Le glutamate déshydrogénase

De quoi dépend le sens des réactions de désamination?
De la concentration relative des glutamates, de l’alpha-cétoglutarate et de l’ammoniaque libre dans le milieu.

Qu’est ce qui arrive, par rapport aux désaminations, durant un repas ou après l’ingestion d’un bolus alimentaire qui contient des protéines?
La concentration de glutamate augmente dans le foie et la réaction favorisée sera celle de la désamination oxydative pour former de l’ammoniaque libre
Quel résultat de la désamination oxydative présente une toxicité et qu’est ce que le corps fait pour l’éliminer?
Compte tenu de la toxicité de l’ammoniaque libre, le NH3 est rapidement éliminé par plusieurs voies métaboliques dont le principal est le cycle de l’urée.
Quelle est la forme majeure d’élimination d’azote? Quel pourcentage d’élimination représente cette forme?
L’urée
80-90%
Résumez la formation de l’urée.
- Le glutamate, sous l’action de l’asparate aminotransférase et le glutamate déshydrogénase, fournit l’aspartate et le NH3.
- Les deux amines produites (NH3 et aspartate) se condensent en plusieurs étapes successives, mitochondriale et cytosolique, pour former l’urée.
- Le carbone et l’oxygène de l’urée sont dérivés du CO2 libre

Combien d’azote contient l’urée et d’où vient chacun des azotes? D’où vient le carbone de l’urée?
2 azotes: 1 qui vient de l’ammoniac libre, 1 qui vient de l’aspartate
Le carbone vient du CO2.

Où est produite l’urée et où est-elle relâchée? Elle est majortiairement éliminée par où?
L’urée produite au niveau du foie est relâchée dans la circulation sanguine pour être majoritairement éliminée dans l’urine.
Qu’arrive-t-il à une partie de l’urée dans le sang plutôt que de se retrouver dans l’urine?
Diffuse du sang vers l’intestin pour être dégradée en NH3 et en CO2 par l’uréase bactérienne.
Une partie de cet azote produite peut être réabsorbée à nouveau par les entérocytes, pour se trouver dans la circulation sanguine.
Qu’arrive-t-il en cas d’insuffisance rénale quant à la production d’urée? C’est quoi le problème?
- Augmentation de l’urée car non éliminé par les reins
- Augmentation de la captation de l’urée par l’intestin
- Augmentation du NH3 produit par les bactéries intestinales
- Augmentation du NH3 réabsorbé par les entérocytes
- Augmentation du NH3 sanguin
Problème: L’ammonique (NH3) produit est très toxique.
Expliquez pourquoi l’ammoniaque produite est très toxique.
a-cétoglutarate + NADPH + H+ + NH3 ⇔ glutamate + NADP+
Augmentation de l’ammoniaque favorise la production de glutamate (acide glutamique), donc
Limite la disponibilité de l’alpha-cétoglutarate, intermédiaire essentiel dans le cycle de l’acide citrique, donc
Nette diminution de production d’ATP
Le cerveau très sensible à ce changement car son métabolisme dépend directement du cycle de Krebs pour la production de l’énergie dont il a besoin, donc troubles neurologiques

Quels sont les 2 principaux mécanismes d’élimination d’ammoniaque?
- Cycle de l’urée
- Formation de glutamine (porteur non toxique d’ammoniaque)
Quels sont les principaux sites de fabrication de la glutamine?
Les muscles, le foie et le système nerveux
Comment est la glutamine au niveau musculaire?
Au niveau musculaire, la glutamine comprend environ 60 % du pool d’acides aminés intracellulaire, et sa concentration intracellulaire à ce niveau est 30 fois supérieure à celle du plasma
Quelle est la différence entre glutamine et glutamate?
Glutamine: chargé de deux azotes, transporteur par excellence d’azote
Glutamate: Molécule qui a un seul azote

Outre la dégradation des acides aminés par le foie, quelles sont d’autres sources de production d’ammoniaque dans le métabolisme?
- Les reins, sous l’action de la glutaminase rénale, produisent du NH3.
- De plus, plusieurs produits organiques relâchent de l’ammoniaque après leur catabolisme. C’est le cas des purines, des pyrimidines, et de certains neurotransmetteurs.
Que produit la catabolisme de la chaine carbonée des acides aminés?
- Le pyruvate
- l’acétyl-CoA
- l’acéto-acétate
- l’oxalo-acétate
- la fumarate
- l’alpha-cétoglutarate
- le succinyl CoA.
Que font les produits du catabolisme de la chaine carbonnée des acides aminés, et ils interviennent dans quel cycle?
Ces produits de dégradation entrent directement ou indirectement dans le cycle de Krebs pour produire de l’énergie ou produire du glucose et des acides gras par l’intermédiaire de l’acétyl CoA et du malonyl CoA
C’est quoi des acides aminés cétogéniques ou cétoniques?
Les acides aminés qui produisent surtout l’acéto-acétate ou l’acétyl-CoA, i.e. leur chaîne carbonée se retrouve dans le corps cétonique produit comme l’acétone.
C’est quoi des acides aminés glucogéniques?
Les acides aminés qui produisent du pyruvate ou un intermédiaire du cycle de l’acide citrique. Ces intermédiaires sont des substrats utilisés dans la gluconéogenèse
Est ce que l’acétoacétate est un corps cétonique?
Oui

À partir de quoi se fait la synthèse des acides aminés?
À partir des intermédiaires de la glycolyse du cycle de l’acide citrique ou de la voie des pentoses
D’où proviennent les azotes des acides aminés?
Les azotes des acides aminés proviennent des glutamates et glutamine.
Est ce que la complexité des voies de synthèse est pareille pour tous les acides aminés?
Non
La complexité des voies de synthèse varie selon la structure des chaînes latérales. Cette figure nous démontre les principales étapes de la synthèse de la sérine et la glycine à partir de la 3-phosphoglycérate dérivé de la voie glycolytique.

Quel acide aminé peut être synthétisé à partir de la méthionine?
La cystéine

Des intermédiaires tels que le 3-phosphoglycérate peuvent donner quels acides aminés?
La sérine et la glycine

C’est quoi un acide aminé essentiel?
A.A. qui ne peuvent pas être produits par notre organisme, doivent être présents dans l’alimentation, sinon une carence s’ensuit
Ceci aura des conséquences sur la synthèse protéique et sur la formation de plusieurs sous produits biochimiques.
V ou F? Un acide aminé non essentiel peut avoir un acide aminé essentiel comme précurseur.
Vrai.
C’est le cas de la L-cystéine, un acide aminé non essentiel produit à partir de la méthionine, un acide aminé essentiel
Quels sont les acides aminés essentiels?
PVT TIM HALL:
Phénylalanine, Valine, Tryptophane, Thréonine, Isoleucine, Methionine, Histidine, Arginine, Leucine, Lysine

C’est quoi une protéine?
Chimiquement, les protéines sont des polymères d’acides aminés liées entre eux par des liaisons peptidiques.
Qu’est ce qui forme une liaison peptidique?
La liaison linéaire entre les groupements a-aminés et a-carboxyle de deux acides aminés
Résumer la formation des liaisons peptidiques dans une protéine. Comment appelle-t-on les extrémités d’une protéine?
Formation d’une liaison peptidique.
Le dipeptide résultant réagira à son tour avec un groupement a-aminés d’un autre acide aminé pour former un tri-peptide et la réaction continue d’une façon successive jusqu’à l’obtention de la chaîne peptidique désiré.
L’extrémité qui contient le groupe ammonium libre (NH3+) est appelé le N-terminal, alors que l’extrémité du groupe carboxyle est le C-terminal.

Résumez la structure primaire des protéines
La séquence spécifique des acides aminés forme la structure primaire des peptides et des protéines.
La nature du groupe R des acides aminés joue un rôle primordial dans la détermination des propriétés physico-chimiques de la chaîne peptidique ou protéique.
Elle est déterminée génétiquement par la séquence d’ADN codante.
Qu’est ce qui détermine la structure secondaire des protéines? Qu’est ce qui la stabilise? Donnez des exemples de structures de structures secondaires.
La combinaison bien précise des angles formés au niveau des liens peptidiques détermine la structure secondaire des peptides et des protéines.
Cette structure est stabilisée par des ponts hydrogènes internes à la chaîne peptidique ou entre deux chaînes voisines.
Nous avons la structure en hélice-a (hélice du collagène), en feuillet β, ou en structure en coude, il existe d’autres structures aussi, comme la forme d’hélice aléatoire ou désordonné .
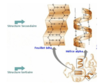
Résumez la structure tertiaire d’une protéine.
La structure repliée en trois dimensions des chaînes peptidiques, qui constitue la conformation biologiquement active d’une protéine.
La structure tertiaire est essentiellement déterminée par cristallographie.
Apparition des ponts disulfure.
Résumez la structure quaternaire des protéines.
Certaines molécules protéiques individuelles (monomères) s’associent par des interactions non covalentes pour former des complexes symétriques qu’on appelle dimère ou oligomère.
Ce complexe structural possède un axe de symétrie et il sera important dans l’accomplissement de plusieurs fonctions biologiques (enzymes, hormones, récepteurs, autres).
C’est quoi une hétéroprotéine?
Protéines qui ont fixé un groupement prosthétique (mot forgé à partir de termes grecs qui signifie addition d’une partie supplémentaire).
La structure du groupement prosthétique détermine la nature des hétéroprotéines.

C’est quoi une protéine fibrillaire?
Par définition, une protéine est dite fibrillaire lorsqu’un de ses axes est au moins 10 fois supérieur aux deux autres. Une molécule de protéines fibrillaires peut comporter en plus des domaines fibrillaires de domaines globulaires (Ex : la molécule de fibrinogène).
Donnez un exemple de protéine fibrillaire.
La fibrinogène.

Le fibrinogène est un bon exemple de protéines fibrillaires. C’est une molécule très soluble qui circule dans le plasma sanguin. Un clivage protéolytique des deux noyaux globulaires de la molécule déclenche un processus de polymérisation qui aboutit à la formation de la fibrine. Cette dernière forme un réseau enserrant dans ses mailles les globules rouges et blancs. C’est le caillot sanguin.
C’est quoi une protéine globulaire?
Les protéines globulaires ont une forme générale plus ou moins sphérique (globulaire). Elles présentent une structure bien définie qui est indispensable à leurs actions biologiques.
Donnez un exemple de protéine globulaire.
. La myoglobine est un autre exemple d’une protéine globulaire, elle est une chromoprotéine globulaire présente dans les muscles, chargée de fixer l’oxygène apporté par l’hémoglobine des globules rouges circulants.
Le groupement prothétique de la myoglobine (le fer) est situé dans une sorte de crevasse centrale et il donnera à la molécule sa couleur rouge.

Comment exprime-t-on la masse d’une protéine? Sa taille? Par quoi estime-t-on sa charge?
Les protéines sont des macromolécules qui se caractérisent par une masse exprimée en dalton (d) qui peut s’échelonner de 10,000 à plusieurs millions daltons, une taille exprimée en unité Angström (Å), une charge qui résulte de la nature de ses acides aminés, elle est estimée par le PI.
Comment se comporte la protéine à un pH en haut et en bas du PI?
Au pH inférieur au PI, la protéine se comporte comme un cation(+). Au pH supérieur au PI, elle se comporte comme un anion(-).
Comment varie la forme d’une protéine? Qu’est-ce qui influence beaucoup la taille d’une protéine?
La forme géométrique d’une protéine varie du sphérique à l’ellipsoïde , son dégrée de saturation en eau influencera de beaucoup sa taille.
Les grosses protéines sont généralement quoi?
Les grosses molécules sont généralement des polymères répétitifs d’une même sous-unité.
Une protéine a de nombreux pouvoirs _______.
Une protéine a de nombreux pouvoirs antigéniques. (surtout glycoprotéines)
Que permet l’étude des caractéristiques physico-chimiques des protéines?
- La purification et l’étude des protéines biologiques
- Développer des outils diagnostiques importants
- Comprendre la base biochimique de nombreuses pathologies
Donnez 6 fonctions possibles des protéines
1-Enzymatique
2-Transport
3-Structure
3-Mobilité cellulaire
4-Communication
5-Signalisation
6-Immunité
7-autres
Donnez 5 exemples de fonctions de protéines en détail (enzymatique, transport, structure, mobilité, communication)
- Certaines d’entre-elles, les enzymes, servent de catalyseurs pour les réactions biochimiques qui se produisent dans l’organisme;
- D’autres sont des transporteurs de certains petites molécules (hémoglobine transporte l’oxygène);
- D’autres ont un rôle de soutien (collagène) de structure (kératine).
- Les protéines musculaires (actine et myosine) ont un rôle contractile, elles peuvent réaliser un travail mécanique en utilisant de l’énergie chimique.
- Certaines protéines ont un rôle de reconnaissance (récepteurs, immunoglobulines).
Comment fonctionne la fonction enzymatique d’une protéine? Où se fait-elle majoritairement?
Les enzymes sont les catalyseurs biochimiques de la cellule. Elles diminuent l’énergie d’activation d’une réaction et permettront ainsi à un substrat quelconque de réagir pour former un produit dans un laps de temps relativement court.

L’activité catalytique de l’enzyme se fait majoritairement à son site actif où se lie généralement le substrat.
Quels sont les 6 principaux groupes enzymatiques?
- Oxydoréductases
- Transférases
- Hydrolases
- Lysases
- Isomérases
- Ligases

Qu’est ce qui constitue en terme quantitatif le groupe le plus important des macromolécules de l’organisme?
Les protéines
Résumez le métabolisme des protéines
Les protéines apportées par la nourriture seront d’abord dégradées en acides aminés dans le tractus gastro-intestinal. Elles seront ensuite absorbées et réparties dans l’organisme.

Combien d’acides aminés protéinogènes l’être humain est incapable de synthétiser?
L’être humain est incapable de synthétiser 10 de ces 20 acides aminés protéinogènes.
À partir de quoi se fait la protéosynthèse?
À partir du pool d’acides amines libres extra et intracellulaire, ce dernier représentant environ 95 % des acides amines libres.
Résumez les grandes étapes de la protéosynthèse.
Les acides aminés libres circulant pénètrent d’abord à l’intérieur des cellules à l’aide de transporteurs.
Les grandes étapes sont :
- la transcription de l’ADN en ARNm
- la traduction de l’ARNm en un peptide
- la maturation protéique qui permet l’acquisition des structures secondaires, tertiaires et quaternaires.
La synthèse protéique consomme combien d’énergie? Est-ce que c’est une quantité importante?
Le coût énergétique de la synthèse protéique est de l’ordre 1 kcal/g de protéine synthétisée.
C’est une quantité importante d’énergie.
Quelle est la principale source d’acides aminés pour l’organisme?
La protéolyse
Quels sont les 3 systèmes spécialisés dans la dégradation des protéines?
Le système lysosomal
Le protéasome (système ATP dépendant)
Le système calpaïne-capastatine
Résumez le système lysosomal
Les protéases de la protéolyse sont actives en milieu acide. Ces enzymes sont localisées surtout à l’intérieur des lysosomes où ils exercent leurs actions
Résumez le fonctionnement du protéasome
Il s’agit d’un complexe enzymatique intracytoplasmique, composé de nombreuses sous-unités.
Les substrats préférentiels de ce protéasome sont les protéines intracellulaires normales.
Préalablement à l’action du protéasome, un marquage de la protéine à dégrader par l’ubiquitine est nécessaire. L’ubiquitine est un petit peptide¸ qui se fixe sur les protéines à dégrader .
Une fois la protéine reconnue par le protéasome, il est dégradé en acides aminés et en peptides courts relâchant l’ubiquitine qui peut alors être réutilisée.
Cette réaction consomme de l’ATP. Elle est régulée par les circonstances nutritionnelles et hormonales.

Résumez le système calpaïne-capastatine
Les calpaïnes sont des protéases cytosoliques dont l’activité est en fonction de la concentration intracellulaire en calcium. Elles sont plus spécialisées dans la dégradation des protéines du cytosquelette.
Le pool d’acides aminés circulants résulte de quoi?
D’un constant anabolisme et catabolisme protéique
Sous quelle forme une partie des acides aminés et de ses dérivés est éliminée? Qu’est-ce qui en résulte?
Sous forme d’azote, de CO2 ou des corps cétoniques. Le résultat de ce processus exige un apport protéique constant et minimal de 30 g par jour chez l’adulte.
Un apport de 30g de protéines par jour est-il facile à atteindre? Qu’est ce qui peut rendre cela plus difficile?
Un tel apport semble être très facile à attribuer dans les pays industrialisés.
Cependant, chez certaines populations pauvres de la planète où l’alimentation est très déficiente en protéines, on peut avoir de la difficulté à atteindre de telles valeurs.
C’est le cas aussi de certains patients qui ont des problèmes digestifs qui les empêchent d’avoir un tel apport.
En Amérique du Nord, qu’est-ce qui caractérise le contenu protéique de notre alimentation? Qu’est-ce que cela cause?
Dans notre société nord-américaine, le contenu protéique d’une ration alimentaire est de beaucoup supérieur à nos besoins en protéines.
Sachant que les acides aminés ne peuvent pas être misent en réserve, approximativement de 50 à 100 g/jour d’acides aminés seront dégradés par le foie et ensuite éliminés du corps sous diverses formes (urée, corps cétonique, CO2, etc.).
Quelle est la proportion d’azote dans les protéines?
Environ 10%
Pourquoi peut-on dire que le métabolisme protéique de l’organisme reflète le bilan azoté de l’organisme?
Les composés non protéiques contenant de l’azote étant faible, le bilan azoté de l’organisme (ingestion d’azote – excrétion d’azote) sera donc le reflet du métabolisme protéique
C’est quoi la balance azotée?
L’indice le plus populaire et le plus utilisé pour évaluer le degré de synthèse (anabolisme) et du catabolisme des protéines.
Il se calcule en utilisant la différence entre l’apport et l’excrétion d’azote.
Un résultat positif signifie une situation d’anabolisme et un résultat négatif, une situation de catabolisme.
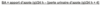
Pourquoi ajoute-t-on 4g dans la balance azotée?
Le 4 g est ajouté pour tenir compte de la perte d’azote fécale ou pour la régénération cutanée.
80% de l’azote urinaire se trouve sous quelle forme?
Sous forme d’urée
Quel pourcentage des dépenses d’énergie de base sont utilisées pour le renouvellement de la masse protéique?
Environ 20%
V ou F? Généralement, plus le rôle d’une protéine est important, moins sa vitesse de rotation est importante
FAUX. Généralement, plus le rôle d’une protéine est important, plus sa vitesse de rotation est importante
En situation de stresse, le pool de protéines de quels tissus sont favorisés, et lesquels sont davantage dégradés?
En situation de stress, le pool des protéines favorisées sont ceux des tissus de réparation et de la fonction immune au détriment de la masse musculaire qui devient pourvoyeur principal d’acides aminés.
Donnez une application clinique de la balance azotée.
La différence entre marasmus et kwarshiorkor.
Marasmus est un déficit protéique et calorique, alors que kwarshiorkor est un déficit uniquement protéique.

Quels sont les 11 acides aminés polaires?
- Polaires neutres
- Sérine
- Thréonine
- Cystéine
- Asparagine
- Glutamine
- Tyrosine
- Polaires chargés +
- Lysine
- Arginine
- Histidine
- Polaires chargés -
- Aspartate
- Glutamate
Quels sont les 9 acides aminés non polaires?
Les autres!
- Glycine
- Alanine
- Valine
- Leucine
- Isoleucine
- Méthionine
- Phénylalanine
- Tryptophane
- Proline
Quels sont les 3 acides aminés contenant un noyau aromatique?
Phénylalanine
Tryptophane
Tyrosine


