C1 CH8 : Les anémies Flashcards
Décrire : Le terme érythron (4)
- désigne l’ensemble anatomique et fonctionnel qui sert à maintenir constante la masse des globules rouges circulants durant la vie humaine
- Chez l’adulte, 200 milliards d’érythrocytes doivent être remplacés chaque jour afin de compenser pour la destruction physiologique d’un nombre équivalent de cellules.
- Du point de vue anatomique, comprend deux compartiments qui sont la moelle osseuse, siège de l’érythropoïèse, et la circulation sanguine, lieu de déversement des érythrocytes transporteurs d’oxygène.
- Du point de vue de sa cinétique, le système comporte également trois compartiments (Figure 1) dont l’équilibre est maintenu ou modifié, selon le besoin, par un système de régulation spécifique impliquant un facteur de croissance, l’érythropoïétine.
Décrire : La prolifération dans l’érythropoïèse (2)
- Dans la moelle osseuse, la cellule progénitrice de l’érythropoïèse ou CFU-E, stimulée par l’érythropoïétine, donne naissance, après 4 ou 5 mitoses successives, à une génération de 16 ou 32 cellules-filles appelées érythroblastes ou normoblastes.
- Dure normalement entre trois et quatre jours, mais elle peut être accélérée selon le besoin, en fonction du degré de stimulation.
Décrire : La maturation dans l’érythropoïèse (2)
- Ce compartiment fonctionnel est caractérisé par l’acquisition progressive des attributs morphologiques et fonctionnels du globule rouge normal: synthèse progressive de l’hémoglobine dans le cytoplasme et perte éventuelle du noyau et du pouvoir de division cellulaire.
- Lorsqu’on examine au microscope un frottis de moelle osseuse, on peut distinguer, selon la quantité d’hémoglobine qu’ils contiennent, des érythroblastes à différents stades de maturation (basophiles, polychromatophiles et orthochromatiques).
- Une fois le noyau expulsé, la cellule devient un réticulocyte prêt à passer dans la circulation.
- Le tout dure environ 5 jours dans la moelle et une journée de plus dans le sang périphérique, journée pendant laquelle les réticulocytes se transforment en globules rouges mûrs.
Le globule rouge mature survit combien de temps? (1)
pendant environ quatre mois (110-120 jours)
Le globule rouge mature survit pendant environ quatre mois (110-120 jours) dans la circulation grâce à quoi? (2)
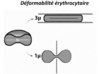
- à son étonnante déformabilité,
- assurée par le maintien d’un métabolisme énergétique normal (glycolyse anaérobie).
Nommez : . Le principal site de destruction physiologique des érythrocytes (1)
est la pulpe rouge de la rate, chargée de macrophages
Une fois l’éryhtrocytes détruit, les constituants vont où? (2)
- L’hémoglobine libérée y est principalement convertie en bilirubine laquelle, après conjugaison au foie avec l’acide glycuronique, est excrétée dans la bile.
- Le fer, lui, est réutilisé pour l’érythropoïèse.
La régulation fonctionnelle de l’érythron est assurée par une boucle de rétroaction classique dont l’intermédiaire est quoi? (1)
est l’érythropoïétine ou EPO
L’érythropoïétine est élaborée et sécrétée par quoi? (1)
principalement par les cellules péritubulaires du rein sous l’influence de la pression partielle en oxygène (PO2) qui prévaut dans la circulation avoisinante.
Nommez : Les principaux effets de l’érythropoïétine (3)
- de stimuler la prolifération des progéniteurs érythropoïétiques (BFU-E et CFU-E),
- d’accélérer la maturation des érythroblastes,
- d’accélérer le passage des réticulocytes au sang circulant.
La résultante normale d’une stimulation par l’érythropoïétine est donc de faire quoi? (2)
- rétablir la masse érythrocytaire devenue incapable d’assurer l’oxygénation adéquate des tissus.
- La moelle osseuse ainsi stimulée peut augmenter sa production érythrocytaire jusqu’à un maximum d’environ huit fois son taux de base.
Nommez les autres co-facteurs de l’érythropoïèse (3)
- la vitamine B12
- l’acide folique
- le fer
Définir : Anémie (2)
- L’anémie est définie par une diminution de la concentration circulante de l’hémoglobine (exprimée en g/l sur la formule sanguine) en deçà des valeurs générale- ment considérées comme normales.
- Il faut noter que la limite inférieure de la concentra- tion normale d’hémoglobine, définie par deux écarts-types sous la moyenne, varie selon l’âge et les circonstances de la vie
C’est quoi la relation entre les sx et signes cliniques de l’anémie et l’hémoglobine?
Ces derniers ne sont pas nécessairement en relation étroite avec la concentration mesurée de l’hémoglobine.
Sur le plan clinique, la tolérance à l’anémie varie comment? (1)
varie de façon importante selon l’âge et l’état général du malade ainsi que selon la rapidité d’installation de l’anémie (les anémies chroniques sont beaucoup mieux tolérées).
L’anémie elle-même comporte peu de manifestations cliniques spécifiques si ce n’est quoi? (3)
- la pâleur : peau, plis de la main, muqueuses (bouche et conjonctives)
- l’asthénie, plus ou moins importante selon le cas
- l’ictère, lorsqu’il y a hémolyse.
Par contre, plusieurs symptômes et signes physiques associés à l’apparition d’une anémie reflètent surtout quoi? (3)
- l’activation de mécanismes compensatoires :
- tachycardie, palpitations, plus marqués à l’effort
- céphalée pulsatile, acouphènes
- dyspnée d’effort, orthopnée, œdème malléolaire.à
- l’état de la circulation : (perméabilité vasculaire)
- angine de poitrine
- claudication intermittente
- ischémie cérébrale transitoire.
- l’expression de la maladie causale :
- fièvre (maladie inflammatoire)
- paresthésies, perte d’équilibre (Maladie de Biermer)
- douleurs épigastriques, méléna, etc. (ulcère gastroduodénal)
- ménorragies et/ou métrorragies.
Nommez : Les principaux mécanismes producteurs d’anémie (3)
- Défaut de prolifération
- Défaut de maturation
- Survie raccourcie des érythrocytes
Les anémies par défaut de prolifération sont causées par quoi? (3)
- 1) par une insuffisance numérique ou fonctionnelle des progéniteurs érythropoïétiques (BFU-E ou CFU-E),
- 2) par une altération quelconque du microenvironnement médullaire ou encore
- 3) par une production ou une efficacité insuffisantes de l’érythropoïétine.
Décrire l’anémie par défaut de maturation (2)
- Une prolifération normale ou accrue est parfois rendue inefficace par l’incapacité des érythroblastes à acquérir leurs caractères morphologiques et fonctionnels normaux,
- ce qui entraîne parfois leur destruction précoce au sein même de la moelle (érythropoïèse inefficace).
L’anémie par défaut de maturation est causée par quoi? (1)
le plus souvent par une carence des cofacteurs essentiels de l’érythropoïèse comme le fer, l’acide folique ou la vitamine B12.
Les anémies par survie raccourcie des érythrocytes résultent de quoi? (3)
- une hémorragie,
- une destruction prématurée des globules rouges in vivo (hémolyse) pouvant survenir dans la circulation elle-même (hémolyse intravasculaire),
- ou dans certains organes comme la rate et le foie (hémolyse extravasculaire).
Les réticulocytes sanguins peuvent être identifiés et énumérés comment? (1)
- par les automates de laboratoire à l’aide de fluorochromes se liant spécifiquement à l’ARN des ribosomes encore présents dans le cytoplasme cellulaire à ce stade de la maturation.