Analgetika Flashcards
Vad heter antagonisten (antidot) till opioider?
Naloxon
Vilka receptorer har opioider?
Delta, kappa, my
Enkephalin, dynorphin, beta-endorfin, endomorphin, nociceptin (prekursor) etc
Vad är ovan exempel på?
Endogena ligander
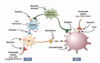
Vilken verkan har opioider i dorsalhornet?
- Aktionspotential från periferi i axon varpå Ca2+-kanaler (N-type) öppnas och Ca2+ flödar in varpå vesiklar frisätter neurotransmittorer i synapsklyftan
- Morfin aktiverar presynaptiska receptorer (finns även postsynaptiskt) som gör att Ca2+inflödet minskar eftersom N-type hämmas. Då frisätts mindre glutamat i synapsklyfta vilket ger mindre depolarisering av dorsalhornsneuronet och mindre nociception når hjärnan –> mindre smärta

På vilket sätt modulerar opioider top-down?
- När opioidreceptorer i PAG (mellan 3:e och 4:e ventrikel) i mecencephalon aktiveras ökar nedåtgående smärthämmande system
- Även noradrenerga system (locus coeruleus) och serotonerga system (Raphe nucleus) deltar

Utöver top-down modulering och hämning av nociception i bakhorn verkar opioider bland annat i
- Amygdala (ångest/oro)
- VTA –> Nucleus accymbens
- Thalamus
- Insula
- ACC
Var och på vilka ytterligare sätt verkar opioider?
-
Andningscentrum
- Andningsdepression som biverkan vid överdoser – antidot (naloxon iv) – toleransutveckling
- Edinger-Westphal-kärnan (n. ockulomotorius) –> mios
- Kemoreceptor trigger zone i 4:e ventrikelns golv –> illamående
- Lokala opioidreceptorer i tarmen –> förstoppning (ingen toleransutveckling)

Hur kan förstoppning vid opioidbehandling förebyggas?
- Laxantia (förebygg)
- Finns per orala opioidantagonister (naloxon) – biotillgänglighet är mkt låg (2 %), alltså ingen effekt på CNS
- Neurologisk bakgrund till opioidberoende?
-
My-receptor är viktigaste gällande beroende och de finns
- På de gabaerga interneuronen i VTA som annars håller tonisk inhibition på de dopaminerga cellerna, nu inihiberas alltså inhibitorn
- I nucleus accumbens – mer oklart hur de bidrar här
-
Morfin
- Biotillgänglighet 30 %
- Halveringstid 2-3 h
Hur metaboliseras morfin?
- Genom konjugering (M3G inaktiv, M6G aktiv)
Fentanylplåster
Vilken egenskap har fentanyl som gör att vi kan ge det som plåster?
Väldigt fettlösligt (morfin mer vattenlösligt)
-
Traditionell uppdelning mellan svaga och starka opioider
- Steg ett – NSAID, paracetamol
- Steg två – svaga opioider
- Kodein (maxdos 240 mg/dygn (motsvarar 1/10 av peroralt morfin), tramadol
- Kallas svaga då maxdos finns angiven i FASS
- Steg tre – starka opioider
Vilken typ av läkemedel är kodein och varför är det viktigt att veta?
- Prodrog då den metaboliseras till morfin via CYP2D6
- 7 % av befolkningen har mindre CYP2D6 – därför risk för utebliven effekt
- 1 % ultrasnabba metaboliserare
- Två effekter
- Låg affinitet för my-receptorn, men aktiv metabolit som har 300 ggr högre affinitet jämfört med modersubstans
- Smärtlindring via monoaminerga nedåtgående smärtinhiberande banor
- Noradrenalin, serotonin
- Benämning ”svag opioid” är traditionell och kan ge falsk säkerhet avseende beroendeproblematiken
- Maxdos 400 mg/dygn (ger ej mer smärtlindring ovan detta)
Vilket läkemedel?
Tramadol
SNRI och tricyklika på smärtindikation
- Vissa antidepressiva har analgetisk effekt
- Framför allt vid neuropatisk smärta
- Tricykliska antidepressiva bäst evidens (amitriptylin)
- Duloxetin (SNRI) – inte SSRI
Vad är verkningsmekanismen?
- Återupptagshämning av monoaminerga substanser (noradrenalin och serotonin) på spinal nivå –> förstärkning av endogen smärthämning
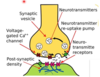
På vilket sätt kan vi smärthämma med hjälp av antiepileptika?
Neuropatisk smärta
- Ovan är första ordningens neurons axon följt av synaps och andra ordningen neuron
- Aktionspotential gör att Ca2+-kanal öppnar sig och Ca2+ inkommer och glutamat kan frisättas i synapsklyfta varpå impulsen kan gå vidare genom att AMPA aktiveras
-
Mekanism
- PREsynaptiskt – N-type kanalen kan påverkas direkt av läkemedel genom att de påverkar alfa-2-delta-subenheten vilket gör att inflöde av Ca2+ minskar och därför minskar glutamatfrisättning

Vilka viktiga antiepileptika som smärthämmar neuropatisk smärta finns det?
-
Gabapentinoider
- Gabapentin (t ex neurontin)
- Pregabalin (lyrica)
- Karbamasepein – vid trigeminusneuralgi

Vad är viktigt att tänka på gällande antiepileptika som medicinering vid smära och biverkningar?
- Metaboliseras inte i lever utan kissas ut –> vid njursvikt ackumuleras det i kroppen!!
NMDA-receptor
- Postsynaptisk aktiveras också NMDA-receptorn som är viktigt vid utveckling av långvarigt smärttillstånd (central sensitisering)
Hur kan vi använda denna information för att smärtlindra?
- Med NMDA-antagonist (Ketamin) kan detta blockeras genom
- Ketamin i låg dos kan användas vid ex cancersmärta (ofta tillsammans med morfin)

Lidokain (plåster) och andra anestetika – lokalbedövning
Mekanism?
- Natriumkanal-blockad (aktionspotentialens fortplantning kräver inflöde av Na+)
- Medlen är svaga baser (BH+ B + H+) och den ojoniserade delen passerar cellmembranet och sedan låses Na+-kanalen inifrån
- Lokal surhet (ex vid infektion) kan göra att vi får mer BH+ varför mindre del passerar cellmembranet –> sämre effekt
Lokalanestetika används inte bara vid kirurgi och anestesi utan kan förskrivas som?
- Plåster vid ex post-herpetisk neuralgi (ex efter bältros, med allodyni), ofta äldre personer (kan vara känsliga för SNRI-preparat som smärtlindring – mer biverkningar)
- NSAID och ASA hämmar COX som annars ger metaboliter av arakidonsyra i form av prostaglandiner – antiinflammatorisk effekt
Skillnad på COX-1 och COX-2?
- COX-1 alltid verksam –> hämning av denna kan ge biverkningar i magen, njursvikt, trombocyter (blödningsrisk)
- COX-2 – inducerbart vid inflammation

Vilken smärthämmande effekt av kortikosteroider?
- Verkar hämmande på fosfolipas A2 som annars deltar i reaktionen där fosfolipider ombildas till arakidonsyra

Hur verkar ASA (modersubstans för NSAID) smärthämmande?
- Irreversibel hämning av COX – viktigt veta då trombocyten (ingen cellkärna) har en livslängd på 7-10 dagar
Hur verkar NSAID (sällan ASA på smärtindikation) smärthämmande och nämn fyra läkemedel av denna typ?
- Viktigast är COX-2-hämningen
- Ibuprofen, naproxen, diklofenak, ketoprofen
Varför har vi inte selektiva COX-2-hämmare?
Selektiva Coxibs – selektiva COX2-inhibitor avregistrerades pga kardivaskulär risk




