QIII - "Welt der molekularen Stoffe" Flashcards
Was sind Monosaccharide?
Einfachzucker oder Monosaccharide sind eine Stoffgruppe von organisch-chemischen Verbindungen. Sie sind die Produkte der partiellen Oxidation mehrwertiger Alkohole. Alle Monosaccharide haben eine Kette aus mindestens drei Kohlenstoffatomen als Grundgerüst und weisen eine Carbonylgruppe sowie mindestens eine Hydroxylgruppe auf.
Man unterscheidet zwischen Aldosen (Monosaccharide mit Aldehydgruppe) und Ketosen (Monosaccharide mit Ketogruppe)
D-Galaktose
häufig vorkommendes Monosaccharid

Wo liegt der Unterschied zwischen Glucose und Galactose?

Glucose
(auch Traubenzucker, häufigstes Monosaccharid)

Wie kommt es zum Ringschluss der Glucose?
- negative Partialladeung am O-Atom bei C1 und positive Partialladung an C1 selbst
- Proton lagert sich an O-Atom an, doppenbindung bricht auf
- O-Atom das C5 lagert sich an C1, H+ wird abgespalten
- H+ lagert sich an O-Atom des C1
- OH an C1 oben = β (auf dem„Bett“ liegen), unten = α („I fall“)
- OH-Gruppe rechts in Fischer = unten in Haworth
In wässriger Lösung stellt sich ein Gleichgewicht zwischen den beiden Halbacetal formen und der offenkettigen Aldehydform ein. Da die zyklischen Strukturen wesentlich stabiler sind, ist die Konzentration der offenkettigen äusserst gering.

Fructose
Ketohexose
- hohe Süsskraft
- reduzierend
- Fehling: positiv

Ringbildung der Fuctose

Warum fällt bei der Fructose die Fehlingprobe positiv aus?
Fehlingprobe fällt positiv aus, aufgrund der Keto-Enol-Tautomerie.
Wie alle Kohlenhydrate besteht Fructose aus einer Kohlenstoffkette, an der jedes C-Atom entweder mit einer Hydroxyl- oder Carbonylgruppe verbunden ist. Damit sind in einem Kohlenhydratmolekül sowohl die funktionelle Gruppe des Alkohols als auch die der Carbonyle vorhanden. Kohlenhydrate besitzen deshalb die Möglichkeit, sowohl wie Alkohole als auch wie Carbonylverbindungen zu reagieren. Beide Verbindungstypen stehen in einem besonderen Verhältnis zueinander, im Klartext: Sie können sich ohne äußere Hilfe ineinander umwandeln. Diese Eigenschaft nennt man Keto-Enol-Tautomerie.

Was sind DIsaccharide?
Verbinden sich zwei Monosaccharide unter Vollacetalbildung miteinander, so entsteht ein Disaccharid. Die Bindung heißt glycosidisch. Auf einen speziellen Zucker bezogen heißt es dann glucosidisch oder fructosidisch.
Alle Disaccharide sind optisch aktiv und haben einen süßen Geschmack, der allerdings unterschiedlich ausgeprägt ist.
Lactose
Disaccharid
Galactose-β-(1→4)-Glucose) Milchzucker
- Fehling: positiv, da anomeres C der Glucose nicht gebunden

Cellobiose
(Glucose-β-(1→4)-Glucose)
Disaccharid der Cellulose

Saccharose
(Glucose-α-(1→2)-Fructose) Rohr- oder Rübenzucker
- nicht reduzierend, keine Ringöffnung möglich, da beide Anemonen C gebunden
- Fehleng: negativ
- fructosemolekül um 180° Gedreht

Was sind Polysaccharide?
Polysaccharide (auch als Vielfachzucker, Glycane/Glykaneoder oder Polyosen bezeichnet) sind Kohlenhydrate, in denen eine große Anzahl (mindestens elf) Monosaccharide (Einfachzucker) über eine glycosidische Bindung verbunden sind.
Beispiele für Polysaccharide sind Glykogen, Stärke (Amylose und Amylopektin), Pektine, Chitin, Callose und Cellulose. Polysaccharide spielen für Pflanzen und Tiere eine wichtige Rolle als Schleimstoffe, Reservestoffe und Nährstoffe. Sie sind zum Beispiel in Getreidekörnern und Kartoffeln vorzufinden. Pflanzliche Zellwände bestehen zu über 50 % aus Cellulose und Hemicellulose, letztere ist ein Gemisch aus Polysacchariden, das eine stützende Funktion in der Zellwand übernimmt.
Cellulose
Die Cellulose ist der Hauptbestandteil von pflanzlichen Zellwänden (Massenanteil 50 %) und damit die häufigste organische Verbindung der Erde. Die Zellulose ist deshalb auch das häufigste Polysaccharid.
Sie ist ein unverzweigtes Polysaccharid, das aus mehreren Hundert bis zehntausend β-D-Glucose-Molekülen ((1→4)β-glykosidische Bindung) besteht. Das 2. Cellulosemolekül ist hierbei um 180° gedreht.
Cellulose ist in Wasser und in den meisten organischen Lösungsmitteln unlöslich. Sie ist jedoch löslich durch eine saure Hydrolyse.
In der Strukturformel der Cellulose ist auffällig, dass der Sauerstoff der glykosidischen Bindung zwischen den Molekülbausteinen abwechselnd nach oben und nach unten zeigt. Das kommt daher, dass die Richtung (nach oben oder unten senkrecht zur „Ringebene“), in die die glycosidische OH-Gruppe bei dem Monosaccharidbaustein zeigt, nicht veränderlich ist, und in die entgegengesetzte Richtung weist, wie die OH-Gruppe am C-4-Atom.

Woraus besteht Stärke?
20-30% Amylose
70-80% Amylopektin
Amylose
Beim Nachweis durch die Iodprobe mittels Iod-Kaliumiodid-Lösung (Lugolsche Lösung) ergibt sich eine Blaufärbung.
Amylose besteht aus ungefähr 100 bis 1400 alpha-Glucose-Bausteinen, die über α-1,4-glykosidische Bindungen miteinander verknüpft sind. Die Amylosekette ist schraubenförmig spiralisiert (helix), nach neueren Daten besteht eine Windung aus 6 bis 7 Glucose-Bausteinen.
An sich ist Amylose so gut wie nicht wasserlöslich, mit heißem Wasser bildet sich jedoch eine kolloidale Suspension.

Amylopektin
Amylopektin besteht aus Tausenden alpha-Glucose-Bausteinen, die hauptsächlich über α-1,4-glykosidische Bindungen, teils aber auch über α-1,6-glykosidische Bindungen miteinander verknüpft sind. Auf diese Weise entstehen Verzweigungen im Molekül. Solche Verzweigungen treten an jedem 20. bis 25. Glucose-Baustein auf.
Ähnlich wie Amylose ist Amylopektin so gut wie nicht wasserlöslich, mit heißem Wasser bildet sich jedoch eine “klare Lösung mit hoher Viskosität“.

Wie Reagiert Stärke mit der Fehlingprobe?
Stärke reagiert mit Fehling negativ, da Aldehydgruppen nur an den Enden der Ketten vorliegen, daher ist die Reaktion so gering das sie nicht erkennbar ist.
Charakteristik von Baumwolle:
- bis zu 65% des Eigenwichts an Wasser aufnehen, ohne zu tropfen
- gute Wasseraufnahme durch Fibrillären Aufbau der Fasern aus Cellulose
- größten Teils unverzierte Ketten
- Wasser kann sich gut anbinden an intramollekularen Wasserstoffbrücken (an freien -OH)
- Wasser unlöslich
- robust und unempfindlich
- dehnbar
- Hitze- und Laugenbeständig
- lange trocken Zeit
Faseraufbau der Wolle

Charakteritik der Wolle
- geringe Reißfestigkeit (viele kovalente Bindungen)
- Dehnbar und elastisch (beim Dehnen Übergang von Helix in ß-Faltblatt)
- gutes Isolationsverhalten (Hohlräume in den Fasern)
- Wasserabweisend (hydrophobe Oberfläche - Cuticula)
- Formverlust bei Heißer Wäsche (irreversible Spaltung der Disulfidbrücken)
- Formänderung beim Waschen mit Seifen ( Pepcid-Bindungen werden hydrolytisch gespalten)
- Hitzeabilität bis ca 150°C, ab 250°C aufbrechen der Wasserstoffbrücken und DIsulfidbrücken
Wie sind Proteine aufgebaut?
Die Verknüpfung von Aminosäuren führt zu Peptiden. Diese unterteilt man nach der Anzahl der Aminosäurereste in der Peptidkette in Oligopeptide (2 bis 9), Polypeptide (10 bis 100) und die makromolekularen Proteine bzw. Eiweiße (mehr als 100).
Formal erfolgt die Verknüpfung durch die Reaktion der Carboxy-Gruppe der Aminosäure 1 mit der Amino-Gruppe der Aminosäure 2 unter Abspaltung eines Wassermoleküls. Die entstehende Carbonsäureamid-Gruppe nennt man Peptidbindung.
Da die Gesamtstruktur von Peptiden sehr komplex ist, unterteilt man sie zur vereinfachten Betrachtung modellhaft in vier Ebenen, die Primär-, Sekundär-, Tertiär- und Quartärstruktur.
Die Primärstruktur
Die Primärstruktur gibt die Aminosäuresequenz, also die Art, Anzahl und Reihenfolge der einzelnen Aminosäuren wieder. Die Verknüpfung der Aminosäuren erfolgt kovalent durch die Peptidbindung.

Die Sekundärstruktur
Die Sekundärstruktur erklärt die räumliche Anordnung einzelner Abschnitte eines Peptids. Diese können entweder die Form einer α-Helix oder einer β-Faltblattstruktur annehmen.

Die α-Helixstruktur
Bei der α-Helixstruktur windet sich die Peptidkette zu einer rechtsgängigen Spirale auf. Dabei stehen die NH-Gruppe einer Windung und die CO-Gruppe der vierten darauffolgenden Aminosäure übereinander.
Die unterschiedlichen Reste der Aminosäuren stehen wie Stacheln nach außen. Der Abstand zwischen zwei Windungen beträgt 540 ppm, auf eine Windung kommen genau 3,6 Aminosäurebausteine.

Die β-Faltblattstruktur
Die β-Faltblattstruktur kann mit einem Leporello oder einer Zick-Zack-Konformation verglichen werden. Durch die Geometrie der Peptidbindung knicken die einzelnen Ebenen (Seiten des Leporellos) immer an den α-Kohlenstoffatomen ab. Die Struktur wird durch gegenüberliegende Peptidketten stabilisiert. Die Reste der Aminosäuren stehen senkrecht oberhalb und unterhalb der Faltblattebene.

Die Tertärstruktur
Die Tertiärstruktur beschreibt die räumliche Struktur einer ganzen Peptidkette. Die Struktur wird häufig mit einer Achterbahn verglichen, da einzelne Bereiche als α-Helix andere als Faltblatt oder auch ungeordnet vorliegen.
Neben Wasserstoffbrückenbindungen, z. B. von der OHGruppe der Aminosäuren Serin oder Tyrosin, oder Ionenbindungen, die sich zwischen den Amino-Gruppen der basischen und den Carboxy- Gruppen der sauren Aminosäuren ausbilden, beobachtet man Van-Der-Waals-Bindungen zwischen unpolaren Seitenketten, die auch hydrophobe Wechselwirkungen genannt werden. Eine weitere Bindungsart, die die Tertiärstruktur maßgeblich prägt, sind kovalente Disulfidbrücken.
Die Disulfidbrücken werden durch zwei Moleküle Cystein gebildet. Die Cysteinmoleküle befinden sich an ganz unterschiedlichen Stellen in der Aminosäuresequenz und bilden so einen „Loop“ in der Peptidkette. Die Tertiärstruktur orientiert sich so, dass polare Seitenketten nach außen ragen, unpolare Seitenketten befinden sich dagegen häufig im „Inneren“ der räumlichen Struktur.

Die Quartiärstruktur
Besteht ein Protein aus mehreren Peptidketten oder hat zusätzlich Bindungen zu Zuckern, Heterocyclen oder anderen Molekülen aufgebaut, spricht man von der Quartärstruktur. Diese Raumstruktur des gesamten Makromoleküls wird prinzipiell durch die gleichen Bindungsarten wie die Tertiärstruktur stabilisiert. Die kovalente Verbindung zweier Ketten erfolgt ebenfalls über Disulfidbrücken.
(Verbindungen mehrere Proteinketten -> Multienzymkomplex)
Wie kommt es zur Peptidbindung?
Wird eine Aminosäure mit einer anderen Aminosäure verknüpft, bildet die Carboxy-Gruppe der ersten Aminosäure mit der Amino-Gruppe der anzuhängenden Aminosäure eine so genannte Peptidbindung unter Freisetzung eines Wasser-Moleküls.
Die nächste Aminosäure wird dann an die Carboxy-Gruppe der zweiten Aminosäure angehängt usw..

Welche Wechselwirkungen gibt es innerhalb der Proteine?
(Stärke abnehmend):
- Elektronenpaarbindungen / kovalente Bindungen
- Ionenbindungen
- Wasserstoffbrücken
- Van-Der-Waals-Bindungen

Elektronenpaarbindungen / kovalente Bindungen

Ionenbindungen

Wasserstoffbrücken

Van-der-Waals-Kräfte

Veränderung von Eiweißstrukturen (Denaturierung)
Durch Erhitzen, Bestrahlen, Zugabe von Säuren, Schwermetall-Ionen oder organischen Lösungsmitteln zu Eiweißlösungen werden die Strukturen meist irreversibel verändert. Diesen Vorgang bezeichnet man als Denaturierung. Bei der Denaturierung werden Strukturen der Eiweiße zerstört, z.B. die räumliche Anordnung der Polypeptidketten zueinander und innerhalb einer Polypeptidkette.
Manche Formen der Denaturierung sind jedoch auch umkehrbar.
Allen Denaturierungsvorgängen ist gemeinsam, dass bei den dafür eingesetzten Bedingungen kovalente Bindungen nicht gespalten werden (außer den Disulfid-Brücken). Die Kettenstruktur und Abfolge der Bausteine (Primärstruktur) bleibt also erhalten. Von der Denaturierung der Proteine zu unterscheiden ist die Proteinspaltung, bei der die Makromoleküle in ihre Bausteine aufgespalten werden.
Denaturierung durch Hitze
durch die Hitzeeinwirkung meist keine kovalenten chemischen Bindungen gebrochen oder gebildet, die Primärstruktur bleibt also unverändert. Stattdessen werden Wasserstoffbrückenbindungen gebrochen oder neu gebildet, das sind in der Regel Bindungen zwischen Kettenabschnitten, wodurch häufig eine Veränderung der Tertiärstruktur bei Enzymen und anderen Proteinen eintritt. Dies hat meist einen Verlust der biologischen Aktivität sowie eine Abnahme der Löslichkeit zur Folge. Letzteres macht sich dann als „Ausflocken“ oder „Gerinnung“ bemerkbar.
Eine Hitzedenaturierung kann (wie andere Denaturierungen) reversibel (umkehrbar)sein, wenn die strukturellen Veränderungen noch nicht zu tiefgreifend sind, ist aber häufig irreversibel (unumkehrbar). Eine Umkehrung ist jedoch unter Laborbedingungen mit Hilfe von Zentrifugen und der Zugabe von Harnstoff möglich.
Denaturierung durch Säurezugabe
Die Säuredenaturierung führt zu Ladungsverschiebungen zwischen den Molekülen und letzten Endes einer Umfaltung des Proteins in den unter den jeweiligen Bedingungen energetisch günstigsten Zustand.
Die Säure gibt Protonen (H+) ab und verursacht damit die Ladungsänderung in der Proteinstruktur, sodass die Wasserstoffbrückenbindungen teilweise zerstört werden und die gleichen positiven Ladungen sich gegenseitig abstoßen. Zusätzlich gibt die Säure Protonen (H+) an die Carboxylatgruppe (COO−) der Aminosäuren Aspartat und Glutamat ab, sodass Carboxygruppen –COOH entstehen und deren vorherigen negativen Ladungen verschwinden. Dies führt dazu, dass keine ionischen Wechselwirkungen zwischen der Carboxygruppe und den positiven Ladungen im Protein mehr möglich sind.
Denaturierung durch Laugezugabe
Auch Laugen ändern die Zusammensetzung der Ionen über den pH-Wert, jedoch werden Aminogruppen von Lysin oder Arginin deprotoniert, wodurch weniger positive Ladungen im Protein vorkommen, die mit negativ geladenen Gruppen wechselwirken könnten. Zusätzlich werden Carbonsäuregruppen zu Carboxylaten deprotoniert, wodurch Wasserstoffbrückenbindungen zerstört werden können und mehr negative Ladungen im Protein auftreten, die sich gegenseitig abstoßen.
Denaturierung durch Ethanol
Entsprechend der Säuredenaturierung kann Ethanol oder andere wasserlösliche, organische Lösungsmittel die in Biopolymeren zur Aufrechterhaltung der Struktur erforderlichen Wasserstoffbrücken und hydrophoben Wechselwirkungen stören, indem es als polares organisches Lösungsmittel interferiert. 50- bis 70-prozentiges Ethanol denaturiert die meisten Proteine und Nukleinsäuren.
Charakteristik von Aminosäuren
- bei Noramltemperatur kristalline Feststoffe
- hoher Schmelzpunkt
- Starke Bindungskräfte zwischen Molekülen
- löslich in polaren Lösungsmittel (sehr gut in H2O)
- besser löslich bei pH-Wert ausserhalb 7
- kann als Zwitterion vorliegen

Wie ist das Protolyseverhalten von Aminosäuren?
- COO- wirk basisch
- Aminosaäuren könne als Ampholyte wirken
- NH2-Gruppe nimmt leichter H+ auf als COO-
Wie ist das Hydrolyseverhalten von Aminosäuren?
- Die Seitenketten von Aminosäuren können polar oder Unmoral sein. Aminosäuren mit polaren Seitenketten können in wässriger Lösung neutral, sauer oder basisch reagieren.
- bei pH > pH(IEP) gibt Ammoniumgruppe (-NH3+) ein Proton ab, es bildet sich die Anionfrom.
- bei pH < pH(IEP) wird die Carboxylatgruppe (-COO-)protolysiert, es entsteht die Kationform.
- Bei der Kationform handelt es sich um eine 2 Protonige Säure, zuerst gibt COOH dann NH3+ ein H+ ab
Wie sieht die ionische Struktur von Aminosäuren aus?

Was ist der Isoelektrische-Punkt?
Punkt an welchem nur der kleinste Anteil an Anionen und Kationen zu gleichen Teilen vorliegt (Anteil=minimal).
Der größte Anteil an Aminosäuren liegt in Zwitterform vor (Anteil=maximal).
Es liegt keine Bewegung im elektrischen Feld vor.
Aminosäuren in Lösungen mit einem pH-Wert, der nicht ihrem IEP entspricht, wandern im elektrischen Feld. (Trennung durch Elektrophorese).
Die Tollensprobe
Nachzuweisende Verbindung:
Aldehyde, reduzierende funktionelle Gruppen
Chemikalien:
Ammoniakalische Silbernitratlösung
Indikatoren:
Silberspiegel
- mögliche Störung:*
- Ablauf:*
Tollensreagenz zu Probe tropfenweise hinzugeben, erwärmen, Ausfällung von elementarem Silber
R-CHO + 2Ag+ + 2OH- -> R-COOH + 2Ag + H2O

Die Fehling-Probe
Nachzuweisende Verbindung:
Aldehyde, reduzierenden Zuckern
Chemikelien:
Kupfer(II)sulfat-Lsg (Fehl.I), Natronlauge, Kalium-Natrium-Tartrat (Fehl.II)
Indikatoren:
rotes Kupfer(I)-oxid
mögliche Störung:
andere reduzierende Verbindungen
nur im alkalischen Milieu
Ablauf:
Beide Lösungen in gleicher Menge zur Probe hinzu, erwärmen,
Reduktion der Cu(II)-Ionen erst zu gelbem Cu(I)-hydroxid (CuOH) und dann eine Dehydratisierung zu Kupfer(I)-oxid (Cu2O), welches als rotbrauner Niederschlag ausfällt.
Aldehyde werden dabei zu Carbonsäuren oxidiert
R-CHO + 2Cu2+ + 4OH- -> R-COOH + Cu2O + 2H2O

Die Schiff’sche Probe
Nachzuweisende Verbindung:
Aldehyde
Chemikalien:
Fuchsin, Schwefelsäure
Indikatoren:
rötlicher Farbton
- mögliche Störung:*
- Ablauf:*
Die Selivarnow-Probe
Nachzuweisende Verbindung:
Ketohexosen (Fructose)
Chemikalien:
Resorcin (ethanolische Lösung), Salzsäure
Indikatoren:
roter Farbstoff
- mögliche Störung:*
- Ablauf:*
Probe mit Salzsäure und einer Resorcinlsg erhitzt
Ketosen bilden dabei 5-Hydroxymethyl-furfural
was mit Resorcin und O2 zu rotem Farbstoff reagiert

Die Xanthoprotein Reaktion
Nachzuweisende Verbindung:
aromatische Aminosäuren
Chemikalien:
Salpetersäure
Indikatoren:
gelbe Farbe
- mögliche Störung:*
- Ablauf:*
einige Tropfen konz. Salpeters. (HNO3), Aromatische Reste und deren Ringe werden nitriert

Die Ninhydrin-Reaktion
Nachzuweisende Verbindung:
a-Aminosäuren
Chemikalien:
Ninhydrin
Indikatoren:
blauviolette Färbung
- mögliche Störung:*
- Ablauf:*
Ninhydrin reagiert mit α-Aminosäuren
die Aminosäure wird unter Desaminierung und Decarboxylierung zum Aldehyd abgebaut
das gebildete Amin reagiert mit einem weiteren Ninhydrinmolekül zum violetten Farbstoff

Die Biuret-Probe
Nachzuweisende Verbindung:
Proteine
Chemikalien:
Natronlauge, Kupfer(II)sulfat-Lösung
Indikatoren:
wasserlöslicher, rotvioletter Komplex aus Cu2+ und Proteinen
- mögliche Störung:*
- Ablauf:*
Probelösung wird mit NaOH und CuSO4 versetzt, Komplexbildung

Kohlenstoff Nachweis
Erhitzen der Probe bis zum verkohlen -> Hinweis auf Kohlenstoff

Nachweis von Stickstoff in Form von Ammoniak
Nachzuweisende Verbindung:
Stickstoff
Chemikalien:
Natronlauge, Universalindikator
Indikatoren:
Geruch
- mögliche Störung:*
- Ablauf:*
Probe wird mit NaOH versetzt und erhitzt
typischer Ammoniak Geruch feststellbar
Univ.Indikator = blau alkalische Reaktion durch das entstehen des Ammoniak bei Proteinzersetzung
Nachweis von Schwefel als Sulfid
Nachzuweisende Verbindung:
Schwefel
Chemikalien:
Natronlauge, Bleiacetat-Papier
Indikatoren:
entstehendes Bleisulfid
- mögliche Störung:*
- Ablauf:*
NaOH zu Eiweisslösung, erhitzen
Bleiacetat-Papier eintauchen, Papier zeigt Schwarzfärbung (PbS)

Iod-Kaliumiodid-Probe
Nachzuweisende Verbindung:
Stärke
Chemikalien:
Lugolsche Lösung
Indikatoren:
blau- bis violettfärbung (bei sehr hoher Konz. schwarz Färbung)
mögliche Störung:
Beim erwärmen zerfällt Verbindung
Ablauf:
I-K-Lsg. auf stärkehaltige Probetropfen
Iod wird in spiralförmige Moleküle eingelagert, Iosstärke Verbindung erscheint Lila

Die Bromwasserprobe
Nachzuweisende Verbindung:
C=C Doppelbindungen
Chemikalien:
Bromwasser
Indikatoren:
Entfärbung von Bromwasser
- mögliche Störung:*
- Ablauf:*
der Lösung tropft man Bromwasser zu und schüttelt nach jeder Tropfenzugabe

Die Kalkwasserprobe
Nachzuweisende Verbindung:
CO2
Chemikalien:
Kalziumhydroxid (Kalkwasser) oder Bariumhydroxid
Indikatoren:
weisser Niederschlag
- mögliche Störung:*
- Ablauf:*
Gas durch wässrige Lösung leiten

Die Glimmspanprobe
Nachweis von Sauerstoff
Glimmender Holzspan wird in Probe gehalten
Aufglimmen als Indikator

Die Knallgasprobe
Nachweis von Wasserstoff
Kontakt mit offenem Feuer (Glut oder Funken) erfolgt
explosionsartige (exotherme) Reaktion von H2 mit O2.

Was sind Thermoplasten?
Kunststoffe, die aus langen linearen Molekülen bestehen. Durch Energiezufuhr werden diese Materialien formbar bis plastisch und schmelzen schließlich. Sie können durch verschiedene Ur- und Umformverfahren in die gewünschte Form gebracht werden. Nachdem das jeweilige Teil abgekühlt ist, behält es seine Form bei. Dieser Prozess ist reversibel.
In Thermoplasten liegen die Makromoleküle hauptsächlich nebeneinander vor. Wird ein solcher Kunststoff erwärmt, können die Moleküle aneinander entlang gleiten und der Gegenstand verformt sich.
Die meisten der heute verwendeten Kunststoffe fallen unter diese Gruppe. Für einfache Konsumwaren, Verpackungen etc. werden sie ebenso häufig eingesetzt, wie für technische Teile in der Automobil- und Elektroindustrie oder in der Bauindustrie, insbesondere für Dachbahnen, Fensterprofile und Rohre.

Was sind Elastomere?
Die Elastomere sind weitmaschig vernetzt und daher flexibel. Sie werden beim Erwärmen nicht weich und sind in den meisten Lösemitteln nicht löslich. Daher werden sie für Hygieneartikel oder Chemikalienhandschuhe verwendet. Die Gummimischung von Autoreifen ist ebenfalls ein Elastomer, das seine Eigenschaften durch Vulkanisation erhält.
Die Makromoleküle der Elastomere bilden dichte “Knäule”. Beim Dehnen eines Gegenstandes aus Elastomeren werden die “Knäule” auseinandergezogen. Lässt man den Gegenstand wieder los, “verknäulen” sich die Moleküle erneut.

Was sind Duroplasten?
Duroplaste sind Polymere, die in einem Härtungsprozess aus einer Schmelze oder Lösung der Komponenten durch eine Vernetzungsreaktion hervorgehen.
Eine Erwärmung von Duroplasten führt nicht zu einer plastischen Verformbarkeit, sondern lediglich zu deren Zersetzung. Ausgehärtete Duroplaste sind meist hart und spröde sowie im weitergehenden Fertigungsprozess nur noch mechanisch bearbeitbar.
Die Duroplasten sind aus Makromolekülen aufgebaut, die engmaschig miteinander vernetzt sind. Dabei entstehen zwischen den Molekülen feste Bindungen, so dass die Moleküle beim Erhitzen nicht aneinander vorbeigleiten können.
Wegen ihrer mechanischen und chemischen Beständigkeit auch bei erhöhten Temperaturen werden sie häufig für Elektroinstallationen verwendet.

Faseraufbau Baumwolle

Was geschieht bei der Kettenpolymerisation?
Bei einer Kettenpolymerisation beginnt das Wachstum mit einem Molekül, an das sukzessive weitere Monomere addiert werden. Das die Polymerisation startende Molekül nennt man Initiator, das auf diesen aufwachsende heißt Monomer. Die Zahl der Monomere, aus denen das Polymer letztendlich besteht, ist der Polymerisationsgrad. Der Polymerisationsgrad kann durch das Verhältnis von Monomer zu Initiator eingestellt werden.
Was ist eine radikalische Polymerisation?
Bei der radikalischen Polymerisation werden die Wachstumsreaktionen durch Radikale initiiert und fortgepflanzt. Sie ist verglichen mit anderen Kettenreaktionen unempfindlich, leicht zu kontrollieren und liefert schon bei recht kleinen Umsätzen hohe Polymerisationsgrade. Sie wird daher vor allem bei der Herstellung von billigen Kunststoffen, wie LDPE (Low-Density-Polyethen), PS oder PVC, eingesetzt. Die entstehenden Produkte sind stark verzweigt.
Eine Gefahr bei diesem Verfahren stellt die freiwerdende Polymerisationswärme dar. Die radikalische Polymerisation ist exotherm. Diese Wärme erzeugt, wenn sie nicht abgeführt wird, weitere Radikale, so dass sich die Reaktion selbst beschleunigen kann. Im Extremfall kann eine solche „Selbstbeschleunigung“ zur Überlastung des Reaktormaterials und damit zu einer thermischen Explosion führen.
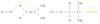
In welche Schritte lässt sich eine Polymerisationsraktion teilen?
- Initiation (auch als Kettenstart oder Primärreaktion bezeichnet)
- Wachstumsreaktion (auch Aufbau- oder Fortpflanzungsreaktion oder Propagation genannt)
- Kettenübertragung
- Kettenabbruch (Termination)
Wie verläuft die Initiation einer radikalischen Kettenpolymerisation?
Zur Initiation der Reaktion dient ein sogenannter “Starter”, der Radikale liefert.
Die entstandenen Radikale mit ihren ungepaarten Elektronen versuchen jetzt, Elektronen zu finden, die sie mit ihrem einzelnen Elektron paaren können, um wieder “komplett” zu sein. Gute Elektronenlieferanten sind C=C-Doppelbindungen, wie sie z.B. in Ethen vorkommen, denn diese sind leicht von Radikalen angreifbar.
Kommt unser Starterradikal also in die Nähe eines Ethenmoleküls, schnappt es sich ein Elektron der Doppelbindung und geht damit eine Bindung zum Ethen ein. Wer die Elektronen nachzählt, stellt fest, dass aber auch jetzt ein ungepaartes Elektron übrigbleibt, wir haben also immer noch ein Radikal (wenn auch ein größeres), das mit einem weiteren Ethenmolekül reagieren kann, d.h. die Kettenreaktion hat begonnen.

Wie verläuft eine radikalische Wachstumsrektion?
Hier geschieht, wie der Name sagt, das Wachstum der Moleküle, d.h. im Falle der radikalischen Polymerisation, dass das Radikal immer wieder mit Ethenmolekülen reagiert und die Molekülkette somit immer länger wird.
Eine Reaktion wie diese, die von sich aus immer weitergeht, solange noch reaktionsfähige Teilchen vorhanden sind, wird “Kettenreaktion” genannt. Theoretisch könnte sie immer weitergehen, aber neben der Wachstumsreaktion gibt es auch andere Reaktionen, die ein weiteres Wachstum der Kette verhindern, indem sie Radikale “vernichten” und so zum Kettenabbruch führen.
Wie kommt es zum Kettenabruch (Termination)?
Der Abbruch einer radikalischen Kettenreaktion geschieht am häufigsten durch Rekombination oder durch Disproportionierung, man kann aber auch “Radikalfänger” zum Reaktionsgemisch hinzugeben, die - wie ihr Name sagt - die Radikale wegfangen, sodass sie nicht weiterreagieren können.
Wie geschieht ein Kettenabbruch durch Rekombination?
Bei der Rekombination bilden zwei Radikale aus ihren beiden ungepaarten Elektronen ein bindendes Elektronenpaar, aus zwei Teilchen entsteht also eines, das kein Radikal und somit nicht mehr reaktiv ist.

Wie kommt es zum Kettenabbruch durch Disproportionierung?
Diese Art des Kettenabbruchs ist etwas komplexer als die Rekombination, sie beruht darauf, dass ein Radikal sich statt dem ungepaarten Elektron eines anderen Radikals auch ein Elektron mitsamt Wasserstoffatom aus einer C-H-Bindung eines anderen Radikals schnappen kann, mit seinem ungepaarten Elektron und dem Wasserstoffatom nun selbst eine C-H-Bindung ausbilden kann und somit kein Radikal mehr ist. Genauer gesagt, nimmt es einem anderen Radikal dasjenige Wasserstoffatom mitsamt Elektron weg, das dem Kohlenstoffatom mit dem ungepaarten Elektron benachbart ist. Das andere Radikal besitzt nun zwei ungepaarte Elektronen, die sich allerdings am benachbarten C- Atomen befinden, sodass sie sich leicht zu einem bindenden Elektronenpaar zusammentun können, wodurch eine Doppelbindung entsteht.
Fazit: Es entstehen ein Alkan und ein Alken, keines von beiden besitzt noch ungepaarte Elektronen, die radikalische Kettenreaktion ist hier zu Ende.

Was ist eine anionische Polymerisation?
Bei der anionischen Polymerisation bilden die Monomere eine wachsende Anionenkette.
Im Cyanoacrylatmolekül ist die Ethylen-Doppelbindung aufgrund des Elektronenzugs durch die Ester- und Nitrilgruppe stark polarisiert.
Am positiven linken Ende der Ethylenbindung kann ein Wassermolekül (z. B. aus der Luft) andocken. In der Folge klappt das Elektronenpaar zum rechten C-Atom, das dadurch eine negative Ladung bekommt.
An diese negative Ladung koppelt jetzt ein anderes Cyanoacrylatmolekül an.
Diese Kettenreaktion ist beendet, wenn alle Monomere verbraucht sind. Die beiden Ladungen der Polymerkette gleichen sich durch Protonenaustausch aus.

Was ist eine kationische Polymerisation?
Bei der kationischen Polymerisation bilden die Monomere eine wachsende Kationenkette. Diese Reaktion soll anhand der Polymerisation von Styrol dargestellt werden.
Zu Beginn der Reaktion lagert sich ein Proton (z. B. aus zugefügter Schwefelsäure) an das linke Kohlenstoffatom an. Da zur Bindung ein Elektronenpaar benötigt wird, klappt ein Elektronenpaar der Doppelbindung des Styrols zum H+-Ion und verbindet es mit dem roten Kohlenstoffatom. Am rechten Kohlenstoffatom fehlt jetzt ein Elektron; es ist daher positiv geladen.
Dieses Kation vermag wieder ein Styrolmolekül zu binden - und so weiter.
Die Polymerisation schreitet voran, bis entweder die Monomere verbraucht sind oder das positiv geladene Ende eines Polymers auf ein negatives Ion wie das HSO4--Ion trifft, das bei der Dissoziation der Schwefelsäure entstanden ist.

Was geschieht bei der Stufenpolymerisation?
Im Gegensatz zur Kettenpolymerisationen erfolgt in Stufenpolymerisationen die Bildung der Polymere nicht durch Initiation einer wachsenden Kette, die weiter sukzessive Monomere addiert, sondern durch direkte Reaktion der Monomere untereinander. Diese Reaktion kann unter Freisetzung eines Nebenprodukts wie Wasser (Polykondensation) oder durch einfache Addition der Monomere zu einer neuen Spezies (Polyaddition) erfolgen.
Was ist eine Polykondensation?
Bei Polykondensationen erfolgt die Bildung der linearen Kette durch intermolekulare Reaktion bifunktioneller Polymere unter Abspaltung einer kleineren Spezies, wie beispielsweise Wasser.
Beispiel Polyamide:
Carbonsäuren reagieren mit Aminen zu Amiden. Setzt man Moleküle ein, die zwei Carbonsäuregruppen tragen, kann eines dieser Moleküle mit zwei Aminen reagieren. Es entsteht so ein Polymer aus drei Monomeren (eine Carbonsäureeinheit, zwei Amine). Tragen die eingesetzten Amine auch wieder zwei Amingruppen, kann die zuvor entstandene Spezies wiederum mit zwei Carbonsäuremolekülen reagieren usw.
Durch Reaktion von Dicarbonsäuren mit Diolen (Dialkohol) werden so Polyester hergestellt. Unter den wichtigsten durch Polykondensation hergestellten Kunststoffen sind Polyethylenterephthalat (PET), ein Polyester, Nylon, ein Polyamid und Bakelit, ein Duroplast.

Was ist eine Polyaddition?
Bei Polyadditionen erfolgt die Bildung des Polymers durch Addition der einzelnen Monomere untereinander, ohne die Bildung von Nebenprodukten.
Beispiel Polyurethane:
Isocyanate reagieren mit Alkoholen in einer Additionsreaktion zu sogenannten Urethanen. Auch hier gilt: setzt man bifunktionelle Monomere ein, erfolgt die Bildung langer linearer Ketten. Auf diese Weise hergestelltes Polyurethan wird für Armaturenbretter, Lacke, Klebstoffe etc. verwendet.
Setzt man der Polymerisationsmischung Wasser zu, reagiert dieses mit den Isocyanaten zu Aminen und Kohlenstoffdioxid. Das in der Mischung freiwerdende CO2 wird in Form von Bläschen in den Kunststoff eingeschlossen, so dass man einen Schaumstoff erhält. Polyurethanschaumstoff wird für Matratzen, Sitzmöbel, Schwämme, etc. verwendet.

Vergleich von Kettenpolymerisation, Polykondensation und Polyaddition

Merkmale einer Polykondensation
Verbindendes Merkmal der Polykondensation ist die Verknüpfung von Monomeren, die mindestens zwei reaktionsfähige funktionelle Gruppen tragen, zu einem Makromolekül. Dabei werden einfache, niedermolekulare Reaktionsnebenprodukte wie Wasser, Alkohole, Ammoniak oder Chlorwasserstoff abgespalten.
Polyethylenterephthalat (PET)
Ausgangsstoffe für die Synthese von Polyestern sind im einfachsten Fall eine beliebige Dicarbonsäure und ein Diol. Daraus entsteht zunächst ein Ester, der bifunktionell ist, weil er immer noch eine Hydroxy- und eine Carboxy-Gruppe besitzt. Durch vielfache Wiederholung der Veresterung an diesen beiden funktionellen Gruppen bildet sich ein linearer Polyester, wobei Wasser als Nebenprodukt anfällt.
Für die Herstellung von Polyestern kann man auch von den reaktiven Carbonsäurechloriden ausgehen und diese mit einem Diol umsetzen. In diesem Fall entsteht Chlorwasserstoff als Nebenprodukt. Letztlich kommt es bei der Polyestersynthese nur darauf an, Monomere mit zwei funktionellen Gruppen immer wieder miteinander zu einer Esterbindung zu verknüpfen.
Low Density Polyethen (LDPE):
- unter hohem Druck bei radikalischer Polymerisation hergestellt
- geringe Härte
- weniger zugfest
- geringe Hitzeabilität
- geringe Dichte, verzweigte Ketten
High Density Polyethen (HDPE):
- bei Niedrigdruck durch Polymerisation mit metallorganischen Katalysatoren hergestellt
- hohe Härte
- zugfest
- höhere Hitzeabilität (-> Duroplast)
- hohe Dichte, wenig verzweigt, parallele Ketten
- Polymere sind unverzweigter, dadurch dichter und stabiler (geordnete/kristalline Bereiche)
Wie funktioniert die Esterbildung?
Die Veresterung ist eine Gleichgewichts- und Kondensationsreaktion, bei der sich ein Alkohol mit einer Säure zu einem Ester paart. Säurekomponente kann eine organische Säure (z. B. Essigsäure, Benzoesäure, Zitronensäure) oder eine anorganische Säure (z. B. Schwefelsäure, Salpetersäure, Phosphorsäure) sein.
Dieser Reaktion liegt folgende Gesamtgleichung zugrunde:
Die Veresterung wird durch Säuren katalysiert. Dabei greift der Alkohol über das Sauerstoff-Atom nucleophil am Carbonyl-Kohlenstoff-Atom der Carbonsäure an. Dieser nucleophile Angriff wird durch die vorherige Protonierung des Carbonyl-Sauerstoffs erleichtert.
Daraufhin findet eine Umprotonierung statt.
Aus diesem Zwischenprodukt kann Wasser abgepalten werden und im letzten Schritt wird der Ester durch Deprotonierung freigesetzt.
Alle Teilschritte dieses Mechanismus sind reversible Reaktionen eines chemischen Gleichgewichts. Es ist also auch möglich, einen Ester säurekatalysiert in einen Alkohol und eine Carbonsäure zu spalten. Es hängt von den Reaktionsbedingungen und den Konzentrationen der Edukte bzw. Produkte ab, auf welcher Seite das Gleichgewicht liegt. Durch die Verwendung von konzentrierter Schwefelsäure als Katalysator kann auch das bei der Reaktion gebildete Wasser dem Gleichgewicht entzogen werden.

Wie funktioniert die Polyamidbildung?
Bei der säurekatalysierten Amidbildung lagert sich im ersten Schritt ein Proton an das Carbonyl-Sauerstoff-Atom an. Es bildet sich ein Carbokation. Der Aminstickstoff bildet mit seinem freien Elektronenpaar eine kovalente Bindung zum positiv polarisierten Kohlenstoff-Atom. Die positive Ladung verschiebt sich dabei auf das Stickstoff-Atom. Dieses gibt ein Proton (und damit die positive Ladung) ab, das sich an eines der beiden Hydroxy-Sauerstoff-Atome anlagert. Dieses spaltet sich unter Mitnahme seines Elektronenpaars als ungeladenes Wasser-Molekül ab. Die positive Ladung ist nun wieder am Kohlenstoff-Atom lokalisiert. Von der noch vorhandenen Hydroxy-Gruppe wird unter Ausbildung einer Carbonyl-Gruppe ein Proton abgespalten. Ein Carbonsäureamid ist entstanden.

Welche Formen des Recycling gibt es?
Man unterscheidet zwischen drei Recyclingformen:
Unter werkstofflichem (oder physikalischem) Recycling versteht man das Nutzen von Altkunststoffen unter weitgehender Wahrung der stofflichen Eigenschaften.
Nur das rohstoffliche Recycling ist das, was wir unter chemischem Recycling im engsten Sinne verstehen. Man gewinnt durch Zerlegen der Makromoleküle in kleinere Moleküle neue Wertstoffe, die zur chemischen Synthese dienen können.
Energetisches (oder thermisches) Recycling ist Verbrennen zur Gewinnung von Prozesswärme.
Was versteht man unter werkstofflichem Recycling?
Hierzu gehört das Umschmelzen oder Umsintern von Kunststoffen, das natürlich nur mit Thermoplasten funktioniert.
Einige Kunststoffe lassen sich gut lösen und damit im Volumen bedeutend reduzieren. Aus dieser Lösung heraus kann der Schaumstoff durch Einblasen von Inertgasen wie Kohlenstoffdioxid oder durch einfaches Erwärmen wieder gewonnen werden.
Gummi wird mit flüssigem Stickstoff tiefgekühlt und dabei spröde wie Glas, dann kann es fein zermahlen werden.
Ein besonderes Problem stellt das Recycling von PVC dar. Wie auch das Gummi lässt es sich nicht einfach rohstofflich recyceln, da es sich beim Erhitzen zersetzt. Man kann aus PVC aber feinstes Granulat herstellen, das dann bei der Neupolymerisation zugesetzt wird.
Wie verläuft das werkstoffliche Recycling?
- Verarbeitung und Zerkleinerung der Abfälle zu Granulat
- Einschmelzung
- Formgebung
Was sind die Anwendungsbereiche für werkstoffliches Recycling?
- Flaschenkästen
- Kunststoff-Flaschen, z.B. PET – „Einweg“ – Flaschen
- Folien
- Gartenmöbel
Welche Vorteile hat das werkstoffliche Recycling?
- echte Wiederverwertung
- kein Müllanfall
- dadurch im Idealfall keine Umweltverschmutzung
Was sind die Nachteile von Werkstofflichem Recycling?
- Gemisch aus verschiedenen Sorten von Kunststoff, daher nur schwer verarbeitbar
- praktikabel nur unter Zufuhr von neuen Rohstoffen: „frischem Kunststoff“
Was verstehen wir unter Rohstofflichem Recycling?
Bei der Verschwelung oder Pyrolyse erhitzt man Stoffe unter Luftausschluss. Dabei zerfallen Makromoleküle in kleinere Verbindungen, die abdestillieren. Diese Stoffe sind meistens ungesättigt. Man kann diese Eigenschaft nutzen, um daraus wieder Kunststoffe herzustellen. Man kann die Schadstoffe aber auch hydrieren und sie als Treibstoffe nutzen.
Manche Kunststoffe zerfallen bereits bei leichtem Erwärmen mehr oder weniger quantitativ in ihre Monomere. Ein Beispiel ist der als Rücklichtabdeckung viel genutzte Kunststoff Polymethacrylsäuremethylester (PMMA).
Zur schonenden Rückgewinnung der Momomeren werden die Kunststoffe unter gezieltem Einsatz von Chemikalien in ihre Monomere oder deren Derivate zerlegt.
Polyester wie das Polyethylenterephthalats (PET) können basisch verseift (hydrolysiert) werden.
Von großer Bedeutung als Hochleistungskunststoffe sind die Polycarbonate (PC). Sie lassen sich zur Rückgewinnung der wertvollen Phenolkomponente ebenfalls basisch verseifen.
Das rohstoffliche Recycling umfasst auch chemische Arbeit. Stahlwerke nutzen die Altkunststoffe als Reduktionsmittel für Eisenoxid.
Wie verläuft Rohstoffliches Recycling?
- Pyrolyse: Aufspaltung der Makromoleküle in kleinere Moleküle durch Erhitzen auf ca. 750C°
- keine Sauerstoffzufuhr → keine Verbrennung
- stattdessen: Spaltungsvorgänge der Polymere
- anschließende Destillation: Auftrennung der einzelnen Produkte → Gewinnung von Rohstoffen
Was sind die Vorteile von Rohstofflichem Recycling?
Keine exakte Sortierung notwendig
Was sind die Nachteile von Rohstofflichem Recycling?
Hohe Kosten bei Auftrennung des Gemisches nach Pyrolyse, es müssen neue Kunststoffe als Ersatz hergestellt werden.
Wie verläuft thermisches Recycling?
Verbrennung der Stoffe Wärmeenergie wird genutzt.
Was sind Vor- und Nachteile von thermischen Recycling?
Vorteile:
- Kostengünstig, sekundärer Gewinn durch Nutzung der thermischen Energie, kaum Sortierung notwendig.
Nachteile:
- Bildung von giftigen Nebenprodukten, es müssen neue Kunststoffe als Ersatz hergestellt werden.
Was sind die Eigenschaften von Gelen?
Ein Gel besteht aus einem dreidimensionalen Netzwerk eines hochmolekularen Gelbildners (Geliermittel) und einem darin eingelagerten Dispersionsmittel (Flüssigkeit oder Gas) und besitzt eine Steifigkeit, die zwischen der einer Flüssigkeit und der eines Festkörpers liegt. Ein Gel ist immerhin so formbeständig, dass es nicht sofort unter seinem eigenen Gewicht zerfließt, ist aber wesentlich leichter deformierbar als ein Festkörper.
Ist das Dispersionsmittel eine Flüssigkeit, so spricht man von Lyogelen, ist es Wasser, von Hydrogelen. Aerogele sind Gele mit Luft als Dispersionsmittel. Viele Lyogele sind thixotrop, d.h. sie lassen sich z.B. durch Rühren verflüssigen.
Was sind Lyogele?
Ist das Dispersionsmittel eine Flüssigkeit, so spricht man von Lyogelen
Was sind Hydrogele?
Ist das Dispersionsmittel Wasser, so spricht man von Hydrogelen
Was sind Aerogele?
Ist das Dispersionsmittel Luft, so spricht man von Aerogelen
Wie wirken Gele als Verdicker?
Gele bestehen zumeist aus einem festen, kolloidal verteilten Stoff mit langen oder stark verzweigten Teilchen, dem Geliermittel, und einer Flüssigkeit, dem Dispersionsmittel. Dabei bildet die feste Substanz im Dispersionsmittel ein räumliches Netzwerk, wobei die Teilchen durch Neben- oder Hauptvalenzen miteinander verbunden sind. Ein Polymergel ist ein in einem flüssigen Medium gequollenes polymeres Netzwerk.
Die Eigenschaften der Gele sind abhängig von der Wechselwirkung zwischen Netzwerk und umgebender Flüssigkeit. Handelt es sich bei den Netzwerken um hydrophile Polymere und um Wasser als Quellungsmedium, so spricht man von Hydrogelen. Die Affinität des polymeren Netzwerks zu Wasser beruht auf der Hydratationsenergie, durch die Wassermoleküle angelagert werden, und der Polymerentropie, die zur Aufweitung bzw. “Entfaltung” der im trockenen Zustand verknäult vorliegenden Polymermoleküle führt. Indem sich das Polymerknäuel aufweitet, bindet es Wassermoleküle.
Was sind Natürliche organische Verdicker?
Natürliche organische Verdicker spielen vor allem in Lebensmitteln eine große Rolle. Die meisten dieser Substanzen sind Polysaccharide wie Stärke, Pektin, Agarose, Gummi Arabicum und Johannisbrotkernmehl. Auch Polypeptide wie Gelatine und Casein wirken durch die Ausbildung von Wasserstoff-Brückenbindungen etc. als Verdickungsmittel. Dabei genügen schon sehr geringe Mengen dieser Substanzen zur Bildung fester Hydrogele, z.B. 0,2 % Agar oder 0,6 % Gelatine.
Was sind Modifizierte natürliche Verdicker?
Viele Natursubstanzen können modifiziert werden, um die Eigenschaften den jeweiligen Erfordernissen besser anzupassen. Dies geschieht in der Regel durch polymeranaloge Reaktion, die z.B. an den freien Hydroxy-Gruppen von Polysacchariden durchgeführt werden.
Hydroxy gruppe
Alkohole
-OH
Aminogruppe
-NH2
Aldehydgruppe
-COH
Ketogruppe

Carboxy-Gruppe
Carbonsäuren
-COOH
Ester-Gruppe

Phenyl-Gruppe

Was ist ein asymmetrisches C-Atom (C*)?
Kohlenstoffatom, an dem vier verschiedene Substituenten gebunden sind
Was ist Chiralität?
Eigenschaft von Molekülen, die wie Bild und Spiegelbild strukturell unterschiedlich sind
Was ist ein reduzierender Zucker?
Als reduzierende Zucker bezeichnet man in der Biochemie Mono-, Di- oder Oligosaccharide, deren Moleküle in Lösung eine freie Aldehydgruppe besitzen
Was sind Isomere?
Isomere sind chemische Verbindungen der gleichen Summenformel, aber unterschiedlicher chemischer Struktur und teilweise auch mit unterschiedlichen chemischen, physikalischen und biologischen Eigenschaften.
Was sind Anomere?
Anomere sind bei den Strukturen von Kohlenhydraten eine besondere Art von Isomeren, die sich nur in der Konfiguration am anomeren Zentrum unterscheiden. Anomere treten bei Kohlenhydraten und analogen Verbindungen in der zyklischen Form auf. Die Konfiguration am anomeren Zentrum wird durch die Stereodeskriptoren α und β beschrieben, wobei das α-Anomer jenes Isomer ist, bei dem die absolute Konfiguration des anomeren Kohlenstoff-Atomes der Konfiguration des höchstbezifferten chiralen Zentrums entgegengesetzt ist.
Was sind Sterioisomere?
Als Stereoisomere werden Verbindungen gleicher Summenformel und Konstitution bezeichnet, die aber eine unterschiedliche räumliche Struktur aufweisen.
Was sind Enantiomere?
Enantiomere sind Stereoisomere chemischer Verbindungen, die in ihrer Konstitution übereinstimmen, sie besitzen also die gleiche Summenformel und die Atome sind in gleicher Weise miteinander verknüpft. Da Enantiomere in sämtlichen Stereozentren jeweils die entgegengesetzte Konfiguration besitzen, treten sie stets gepaart auf. Die räumlichen Strukturen eines Enantiomerenpaars verhalten sich zueinander exakt wie Bild und Spiegelbild. Daher nennt man sie auch Spiegelbildisomere.
Sie können nicht durch Drehung von Atombindungen zur Deckung gebracht werden.
Was sind Derivate?
Derivate sind Stoffe, deren Moleküle an Stelle eines H-Atoms oder einer funktionellen Gruppe ein anderes Atom oder eine andere Atomgruppe besitzen bzw. bei denen ein oder mehrere Atome/Atomgruppen entfernt wurden. Derivate einer Stammverbindung haben meist deutlich verschiedene chemische und physikalische Eigenschaften im Vergleich zu der Stammverbindung.
Die Herstellung eines Derivates bezeichnet man als Derivatisierung.
Was ist eine Substitution?
eine chemische Reaktion, bei der Atome oder Atomgruppen (Substituenten) in einem Molekül durch ein anderes Atom oder eine andere Atomgruppe ersetzt wird, wodurch neue Stoffe entstehen
Was ist eine saure Hydrolyse?
Spaltung einer (bio)chemischen Verbindung durch Reaktion mit Wasser im sauren Milieu
Was ist unter dem Tyndall-Effekt zu verstehen?
ein Begriff, mit dem entweder die elastische Lichtstreuung ganz allgemein oder speziell die Streuung in kolloidalen Lösungen bezeichnet wird
Licht beim Durchgang durch ein trübes Medium (kolloidale Lösung) wird seitlich gestreut. Dadurch wird der durchgehende Lichtstrahl (bei fokussiertem Licht der Lichtkegel) sichtbar, was man als Tyndall-Phänomen bezeichnet.
Was ist eine Elektrophorese?
die Wanderung elektrisch geladener Teilchen durch einen als Trägermaterial dienenden Stoff in einem elektrischen Feld
Was ist unter optischer Aktivität zu verstehen?
Beim Durchgang von linear polarisiertem Licht durch Substanzen mit chiralen Molekülen wird die Polarisationsebene des Lichts gedreht.
Man unterscheidet zwischen rechtsdrehenden (die Polarisationsebene vom Beobachter aus nach rechts drehend) und linksdrehenden Substanzen sowie dem Racemat, der gleichteiligen Mischung aus beidem, das optisch inaktiv ist.
Was ist unter Mutrotation zu verstehen?
Als Mutarotation bezeichnet man nun die Eigenschaft, dass sich der Drehwinkel einer Lösung eines solchen Stoffes vom Zeitpunkt des Ansetzens der Lösung kontinuierlich mit der Zeit bis zum Erreichen eines festen Wertes ändert. An diesem Punkt ist das thermodynamische Gleichgewicht erreicht.
Was bedeutet Kolloidal?
Als Kolloide werden Teilchen oder Tröpfchen bezeichnet, die im Dispersionsmedium (Feststoff, Gas oder Flüssigkeit) fein verteilt sind.
Was bedeutet Amorph?
ein Stoff, bei dem die Atome keine geordneten Strukturen, sondern ein unregelmäßiges Muster ausbilden
Was bedeutet kristallin?
Körper, der aus einer dreidimensional periodisch angeordneten Struktureinheit besteht
Was bedeutet Viskosität?
bezeichnet die Zähflüssigkeit oder Zähigkeit von Flüssigkeiten und Gasen, je größer die Viskosität ist, desto dickflüssiger


