Kapitel 7 - Proteiner & aminosyror Flashcards
Vilka är de funktionella grupperna i en aminosyra?
Amingruppen och karboxylgruppen.
Vad innebär primärstruktur?
Ordningsföljden av aminosyraresterna, eftersom ordning spelar stor roll.
Vad har peptidbindningar för egenskaper?
De har resonansstruktur och har inslag av dubbelbindningar och har därför ingen fri vridbarhet (endast vridbarhet vid alfa-kolet) och aminosyror får viss stelhet.
Vad är Alzheimers sjukdom?
När proteiner veckas fel så fungerar de inte korrekt och måste brytas ned. Gör de inte det kan man drabbas av sjukdomar som Alzheimers.
Ge exempel på två strukturella proteiner
Keratin och aktin
Vad är strukturella proteiner?
Proteiner som ger stadga, skydd och form
Varför är aminoyran oladdad vid pH≈6?
Därför att karboxylsyran är lite starkare och i en netural vattenlösning så kommer alltså inte aminjonen ta upp alla väten som karboxylsyran reagerar bort och vissa kommer att gå till vattnet.
Vad menas med N-terminal och C-terminal?
N-terminal är ena änden på en polypetid (änden med amingruppen), C-terminal är andra änden (den med karboxylsyran)
Vad innebär sekundärstruktur?
Mellan en syreatom i en peptidbindning till en väteatom i en annan peptidbindning kan det bildas vätebindningar som skapar alfa-helix eller beta strukturer. Alltså inte med sidogrupperna att göra.
Hur ser en alfa-helix ut?
Sker när syre i en peptidbindning binder till vätet i en peptidbinding 4 aminosyrarester bort, ofta högervriden, mellan 10-30 aminosyrarester lång. Kan upphöra om en sidogrupp inte passar in.
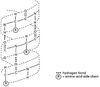
Vad innebär tertiärstruktur?
Det skapas bindningar mellan aminosyraresternas R-grupper (vätebindningar, jonbindningar mellan oprotolyserade R-grupper eller kovalenta bindnginar mellans svalveatomer i cysteinrester. Kan även finnas svaga van der Waals bindningar mellan opolära R-grupper. I cellerna finns vatten överralt och de hydroffoba vänds inåt och laddade polära vänds utåt (<- störst betydelse).
Vad menas med isolektrisk punkt?
Där medelvärdet av hela aminosyrans (inklusive sidogruppens laddningar - som kan ändras beroende på syra/bas) laddningar är 0.
Hur ser en beta-struktur ut?
Om en syreatom i en peptidbindning binder till en väteatom längre bort i polypetiden bildas betastruktur, ex #17 binder till #51, #18 till #52, #19 till #53 o.s.v. Då bildas veck vid alfa kolet i varje aminosyrarest
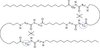
Vad menas med parallell och antiparallel beta-struktur?
Parallell struktur är när N terminalen och C terminalen går från samma håll. I antiparallell struktur så går ena kedjan åt ena hållet (N->C) och andra kedjan går åt andra hållet (C->N)
Vad händer om man värmer ett protein?
Det denatureras genom att bindingarna i sekundär och tertiär -strukturen bryts och proteinet ändrar form och blir olösligt
Vilka övriga ställen hittar man proteiner på?
I cellmembranet för transport och i blodet för transport av fett, och syre. Antikroppar i immunförsvaret. Vissa hormoner. Frön och ägg har det som upplagsnäring.
Vad är globulära proteiner?
Protiner som har hydrofila R-grupper på utsidan blir globulära och lösliga i vatten. Insidan är opoär och dessa proteiner återfinns i ex. cellmembranet.
Vad är funktionella proteriner?
Proteiner som får processer att ske (eznymer)
Vad händer om man låter bly/koppar/bly/kadmium/zink reagera med protein?
De kan förstöra protein genom att skapa svårlösliga föreningar med svalel i R-grupper. Därför ge mjölk till folk som fått i sig metall.
Hur har aminosyror det med asymmetriska centra?
Alla aminosyror har asymmetriska centra förutom Glycin (som endast är en väteatom som sidogrupp).
Vad händer om man tillsätter salt till en lösning med protein i?
Saltets joner binder till laddade R-grupper som gör att proteinet tappar sin form och kan göra vattnet grumligt (utsaltning). Ibland kan proteinet återfå sin form om man späder salthalten.
Vad händer om man ändrar pH för ett protein?
Då kan negativt laddade R-grupper ta upp protoner (syra) eller positivit laddade R-grupper ge ifrån sig protoner (bas). Sura aminosyrarester är nästan alltid protolyserade.
Hur många aminosyrarester måste finnas i ett protein?
Minst 50 aminosyrarester.
Vad händer med en aminsyra i sur lösning?
Karboxylatjonen tar upp ett väte från H3O+ (p.g.a. sur) och blir alltså endast positivt laddad.






