VL 9: Biochemie des lichtgetriebenen Energiestoffwechsels Flashcards
Lichtgetriebene Energiekonservierung
- Photosynthetische Lichtreaktionen
- Antennen
- Reaktionszentren
- Lichtgetriebene Protonenpumpen
- Bakteriorhodopsin (irreführender Name, weil in Haloarchaea vorkkommend)
- Proteorhodopsin
Antennen als Lichtsammler
- Reaktionszentrum
- Komplexe von integralen Membranproteinen
- Stattfindungsort der Ladungstrennung
- nach Lichtsabsorption wird Elektron auf ein negatives Redoxpotential gebracht
- Pigment
- versch. Varianten von Antennensystemen, da RZ alleine nicht ausreichend
- unterschiedl. AS in unterschiedlichen Organismen für efizientes Lichtsammeln

Schematisches Zusammenspiel von Antennensystemen und Reaktionszentren - Cyanobakterien
- Phycobilisomen
- Proteinkomplexe
- mol Masse > ganzes Ribosom
- sitzen auf PS II
- bestehend aus 2 Kern-UE (D1 und D2)
- umgebend von zwei intrinsischen Antennenproteinen (CP 43 und CP 57)
- Chl a und Carotinoid bindend
- Q und FeS
- jeweils erster stabiler elektronenakzeptor nach Lichtreaktion eines Photosystems
- PS II : Q (Chinon/Quinone)
- fettlösliche Elektronencarrier
- 2 Carbonylgruppen
- einzeln nacheeinander reduziert werden können
- PS I: Fe-S
- 4Fe-4S Zentrum
- Cystein-Schwefel
- 1 der 4 Eisenionen valenzwechsel durchlaufen (+3 –> +2 bzw. +2 –> +3)

Elektronencarrier
- Q und FeS
- jeweils erster stabiler elektronenakzeptor nach Lichtreaktion eines Photosystems
- PS II : Q (Chinon/Quinone)
- fettlösliche Elektronencarrier
- 2 Carbonylgruppen
- einzeln nacheeinander reduziert werden können
- PS I: Fe-S
- 4Fe-4S Zentrum
- Cystein-Schwefel
- 1 der 4 Eisenionen valenzwechsel durchlaufen (+3 –> +2 bzw. +2 –> +3)
Schematisches Zusammenspiel von Antennensystemen und Reaktionszentren (RC) - Prochlorophyten
- Prochlorophyten
- besondere Gruppe von Cyanobakterien
- in riesen Konzenrationen in Weltmeeren
- keine Phycobilisomen sondern Chlorophyllbindende Proteine
- fungieren als Antennen
- enthalten Chlb (sonst nur in Chloroplasten)

Antennen und Reaktionszentren Heliobakterien, Purpurbakterien, grüne Schwefelbakterien, Grüne nichtschwefelbakterien
- nur 1 PS in jeweiligen Organismen
- PS II
- Heterodimere (dunkel und hellmagenta)
- Chinon (Q) als Elektronencarrier
- PS I
- Homodimere
- Fe-S-Zentren als Elektronencarrier
- PS II
- Chlorosomen
- Lichtsammel(antennen) Komplexe der Grünen Bakterien
- Lipidmonoschicht Kompartimente
- riesege Anzahl v bChl c, d und e eingeschlossen
- Größe kann variieren
- Grüne Nichtschwefelbakterien
- kleine Chlorosomen
- bis zu 50 000 BChl Moleküle
- Grüne Schwefelbaktrien
- große Chlorosomen
- bis zu 250 000 BChl Moleküle
- keine direkte Interaktion mit RC
- BChl a bindenendes Protein (FannerMatthews-Olson) FMO Protein zwischengeschaltet
- Basalschicht weggelassen
- Spektrale Eigenschaften der Pigmente in jeweiligen Ketten (?)
- erlauben Energietransfer von den Pigmenten in AS bis RC
- BChl c (742nm) ,d,e in Chlorosomen in Rotbereich kurzwelligere Anregungswellenlängen als BChl a in Basalplatte
- BChl a in Basalplatte (792 nm) kurzwelliger als BChl a in FMO Proteinen
- BChl a in FMO (805 nm) kurzwelliger als im RC (865 nm)
- Energiegefälle, sodass thermodynamisch möglich vorgeschaltete Pigmente ihre E an nachgeschaltete Pigmente weiterzugeben
- große Chlorosomen
- Heliobakterien
- nacktes Homodimeres RC
- keinerlei Antennensysteme nachgewiesen
- Purpurbakterien
- RC durch ringförmig angeordnete Proteinkomplexe umgeben
- diese PK enthalten BChl a, Bezeichnung LH

Phycobilisomen
- Antennenkomplexe der Cyanobakterien
- aus 3 Arten von Lichtabsorbierenden Proteinkomplexen
- Allophycocyanin
- sitzt direkt auf RC
- Phycocyanin
- peripher angeordnet
- Phycoerythrin
- peripher angeordnet
- Allophycocyanin

Phycoerythrine, Phycocyanine
- offenkettige Tetrapyrrole
- werden aus Häm gebildet
- kovalent an Cysteinrest der Proteinkette
- unterscheiden sich an Reduktionsgrad
- Spektrale Eigenschaften von Antennen und RC den effizienten Transfer von Lichtenergie
- Phycoerythrine absorbieren im grünen - gelben Bereich des sichtbaren Spektrums
- Phycocyanine im langwelligeren Oragnen
- RC im Roten

Phycobiliproteine und Phycobilisomen, Phycocyanin, Struktur, Anordnung
- (a) Phycocyanin
- typischer Vertreter der Biline
- offenettiges Tetrapyrrol
- biosynthetisch von einem geschlossenen Prrhyrinringsystem durch den Verlust eines Kohlenstoffatoms als Kohlenmonoxis ableitet
- dargestellte Struktur prosthetische Gruppe von Phycocyanin
- kommt bei Cyanobakterien und Rotalgen vor
- (b) Struktur Phycobilisom
- Phycocyanin absorbiert bei höheren Energien (kürzeren Wellenlängen) als Allophycocyanin
- Chl a absorbiert bei längerren WL (niedrigeren Energien) als Allophycocyanin
- Energiefluss
- Phycocyanin –> Allophycocyanin –> Chlorophyll a von PS II
- (c) Elektronenmikroskopische Aufnahme Dünnschnitt Cyanobakterium Synechocyis
- dunkelfarbige, kugelige Phycobilisomen
- an die lamellaern Membranen angeheftet
*
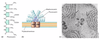
Ringförmige Darstellung der Phycobilisomen
- grundlegender Aufbau von Allophycocyanin, Phycocyanin und Phycooerythrin ist gleich
- alphabeta-Dimere
- Allophycocyanin
- 2 Phycocyanobiline pro alpha-beta-Dimere gebunden
- Phycocyanin
- 3 Phycocyanobiline pro ab-Dimer
- Phycoerythrin
- 5 Erythrobilino pro ab-Dimer
- 3 ab-Dimere lagern sich zu Trimer an
- 2 Trimere lageren sich zu Hexamer an
Superkomplexe aus Phycobilisomen/PSI/PSII
- 2 - 5 Doppelhexamere APS Kern
- in diesem Fall 3 Doppelhexamere
- Anzahl Doppelhexamere Phycocyanins und Phycoerythrins variiert
- abhängig von Stickstoffversorgung der Zellen
- aufgrund der Stickstoffhaltigen AS in Proteinen
- abhängig der Lichtintensität unter der die Bakterien wachsen
*

Light-harvesting Komplexe der Purpurbakterien
- unmittelbar RC herum sitzt LH1
- RC
- absorbieren bei 870 nm
- LH1
- 16 alpha-beta-Dimere
- pro ab-Dimer 2 Chla Moleküle
- absorbieren 850 nm
- peripher LH2
- LH2
- alpha-betaDimere
- versch. Organismen 8-10 fach
- 3 Chla Moleküle, 1 Carotinoid
- absorbieren max. bei 800 nm

Zusammenfassung Antennenkomplexe
- Cyanobakterien
- Phycobilisomen (Phycoerythrine, Phycocyanine
- Purpurbakterien
- LH Komplexe 1 und 2
- Grüne Bakterien
- Chlorosomen
Reaktionszentren
- Typ I
- PS 1
- RC 1
- Grüne Schwefelbakterien, Heliobakterien
- Eisen-Schwefel-Zentrum als Elektronenakzeptor
- Typ II
- PS II
- RC II
- Purpurbakterien, Grüne Nichtschwefelbakterien
- Chinon als Elektronenakzeptor
- Merke
- Das Redox-Potential des reduzierten Fe-S-Akzeptors von Typ I-RC ist deutlich negativer als das des Chinonakzeptors von Typ II-RC
Elektronentransportkette - Cyanobkterien
- nach Lichtreaktion in PS II landet jeweils ein Elektron in stabilen Chinon
- tauscht mit Chinon aus Chinonpool aus Thylakoidmembran
- Cytochrom b6f-Komplex oxidiert reduziertes Chinon, reduziert dabei Kupferion in Plastocyanin (PC), Reduktion durch Aufnahme Elektron von Kuper(II) –> Kupfer (II), durch Abgabe Elektron Rückreaktion Oxidation
- Reoxidation erfolgt am PS-I, Lichtreaktion, Elektron landet im stabilen FeS-Akzeptor
- Redoxpotential des FeS ist negativ genug um damit Ferredoxin zu reduzieren
- reduziertes Fd wird von der Ferredoxin NADP Oxidoreduktase als Elektronendonator genutzt um NADP+ zu NADPH zu reduzieren
- Protonenpotential wird aufgebaut für ATP-Synthase als treibende Kraft

Elektronenfluss bei der oxygenen Photosynthese der Pflanzen (das so genannte Z-Schema)
- Intermediate nach Standardpotentialen angeordnet
- Standardpotentiale der stabilen Akzeptoren (Qb bei PS II und FeS bei PS I) deutlich voneinander unterscheiden
- Elektron landet nicht sofort beim stabilen Elektronenakzeptor, sondern weiter Akzeptoren kurzlebig zwischengeschaltet
- kurzlebig (ps-ns)
- langlebig (mikros-ms)
- beim Zyklischen Elektronenfluss wird ATP synthetisiert aber keine Reduktionskraft aufgebaut
- von Fd zu Cyt bf

Elektronenfluss bei der anoxygenen PS von Purpurbakterien
- Typ II RC
- besitzen nur 1 Typ RC
- nach Lichtreaktion gelangen Elektronen über Bacteriophyophytin zu stabilen QbAkzeptor in Chinonpool, zu Cyt bc1 Komplex
- Elektronen fließen über C-Typ Cytochrom zurück in Reaktionszentrum
- Protonenpotential wird generiert
- zyklischer Elektronentransfer, der keinen exogenen Elektronendonator benötigt
- für CO2 Assimilation muss aber Reduktionskraft regeneriert werden
- rückläufiger Elektronentransport (energie verbrauchend)

Struktur des Reaktionszentrums eines phototrophen Purpurbakteriums
(a) Anordnung der Pigmentmoleküle
- Proteinketten weg, nur noch Cofaktoren
- Zentrum: Special Pair von BChl a (organge), auf die bei Reaktion die gesamte Energie übertragen wird
- unmittelbar benachbarte akzessorische BChl a Moleküle (gelb)
- Bacteriopheophytin Moleküle (blau)
- unten dunkelgelb 2 Chinone
(b) Strukturmodell
- in Membran eingebettet
- 2 integrale Membranproteine (M und L)
- H UE mit RC direkt assoziiert

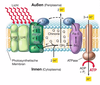
Reaktionszentren - Vergleich
- NADH 320 mV Redoxpotential!!

Bacteriorhodopsin Struktur, Bedeutung
- nicht in Bakterien sondern Halophilen Bakterien
- integrales Mmebranprotein
- protonenpumpendes Chromoprotein
- Sekundärstrukturelemente
- 7 Helikale Bereiche , die Membran drchspannen
- in 7. Transmaemban Helix ist an Lysinrest Retinal gebunden
- Retinal
- all-trans-Retinal
- Cofaktor
- Salzkonzentrationen an Sättigungsgrenze
- Aerobier
- nutzen Bacteriorhodopsin unter sauerstoffmangel
- große Mengen an Bakteriorhodopsin in Membran, purpur
*
Lichtreaktion Bakteriorhopsin
- nach Lichtreaktion all-trans-Retinal zu 13-cis-Retinal
- protonierte Schiffsche Base ihre Position in Protein verändert von Innenseite zur Außenseite wandert
- Proton wird zunächst aus saure AS übertragen und auf Außenseite freigesetzt
- Retinalcofaktor geht wieder in Grundzustand über
- Saure AS wird mit H versorgt
- geht in all-trans Konfig über
Zusammenfassung
- In den verschiedenen Gruppen photosynthetischer Prokaryoten sind Pigmente in der Cytoplasmamembran, in Thylakoiden, intrazellulären membranstapeln oder Vesikeln, oder in Chlorosomen lokalisiert
- Lichtsammelkomplexe (Antennen) leiten die Lichtenergie zu den Reaktionszentren. Als Antennen dienen Phycobilisomen (Cyanobakterien), “light-harvesting”-omplexe (Purpurbakterien) und Chlorosomen (Grüne Bakterien)
- Typ I- und Typ II-Reaktionszentren unterscheiden sich u.a. durch das Redoxpotential des stabilen Primäakzeptors. Typ I-Reaktionszentren ermöglicheen diie direkte Reduktion von NADP+. Typ II_reaktionszentren machen rückläufigen Elektronentransport erforderlich
- Lichtgetriebene Ionenpumpen bilden Protonen-(Bakteriorhodopsin, Proteirhodopsin) oder Chloridgradienten (Halorhodopsin), die der ATP-Synthese bzw. Als Anpassung an Standorte mit hoher Osmolarität dienen


