Biologische Membranen und Kompartimentierungen Flashcards
Funktionen von Biomembranen
Trennen:
- Abgrenzung von Zellen gegen EZF
- Zellkompartimentierung
- Diffusionsbarriere (Ionen, Proteine)
- Ionengradienten (Erregbarkeit)
- Zellantigenität
Verbinden:
- Gasdiffusion
- Kanalproteine
- spezifische Transporter und Austauscher
- Rezeptoren (Signalwandlung)
- Zellverschmelzungen (Befruchtung)
Arten von Biomembranen
Einfachmebranen
Doppelmembranen
bei pflanzen und vielen Prokaryonten ist der Plasmamebran eine zusätzliche Zellwand (komplexe Kohlenhydrate) aufgelagert
Doppelmembranen
- Plasmamembranen (E.coli)
- Mitochondrien
- Zellkern
Einfachmebranen
- Plasmamebran (Eukaryonten)
- endoplasmatisches Retikulum
- Lysosomen
- cis-Golgie, trans-Golgi
Bestandteile von Standardbiomembranen
Lipide (45%, Doppelschicht)
- Phospholipide
- Sphingolipide
- Cholesterol
Proteine (45%, integral, peripher)
- Strukturproteine
- Rezeptoren
- Kanalproteine
- Transporter
Kohlenhydrate (10%, nur außen)
- Glykolipide (Glu, Gal, Ac-Glu)
- Glykoproteine (GalNAc, NANA)
Anteile können je nach Membranart stark variieren

Asymmetrie der Lipiddoppelschicht
äußere Halbschicht (Cholin-haltig):
- Phosphatidylcholin (PC)
- Sphingomyelin (SM)
- Phosphatidylinositol (PL, 1x)
innere Halbschicht (Cholin-frei):
- Phosphatidylethanolamin (PE)
- Phosphatidylserine (PS)
- Phosophatidylinositol (Pl, 2x)
Wie kommt es zur Asymmetrie der Lipiddoppelschicht?
- ATP abhängige Lipidtransporter (Flipasen, Flopasen, Scramblasen) sind für Asymmetrie verantwortlich
- durch asymmetrische Synthase und Aufrechterhaltung durch Enzyme
- abnehmende Asymmetrie ist erstes Anzeichen für beginnenden Zelltod (auch Apoptose)
Arten von Membranproteinen
Integrale Membranproteine
Periphere Membranproteine
Integrale Membranproteine
- Membran-spannend (Ionenkanäle) (zB Aquaporine, mehrere β-Faltblätter bilden den Wasserkanal)
- Membran-überbrückend (Rezeptoren)
- Membran-integriert (eine Halbschicht)
Periphere Membranproteine
- Kopfgruppen-assoziiert (ionische Bindungen)
- Proteinanker (hydrophobe Aminosäuren) (zB COX 1, nimmt benötigte Bestandtiele direkt aus der Membran)
- Lipidanker (zB Fettsäuren, Farnesylreste)
Bewegungen in Biomembranen
Lateraldiffusion
Transversaldiffusion
Lateraldiffusion
- Bewegung innerhlab einer Lipidhalbschicht
- schnell, häufig
- 2 µm/s -> bei Bakterien mit ca. 1 µm Durchzmesser dauerte eine umrundung ca. 2 s
Transversaldiffusion
- Bewegung aus einer Halbschicht in die andere (flip, flop)
- langsam, selten
- ein Flipflop in 4-5h (5 µm Doppelschicht), 108 mal langsamer als Lateraldiffusion
- Wiederherstellung des Ausgangszustandes durch ATP-abhängige Flopase (von Cytosol nach EZ-Seite) und Flipasen (Von EZ- nach Cytosol-Seite) und ATP unabhängige Scramblase (Antiport)
Beeinflussung von Membranfluidität
durch Lipidzusammensetzung
- ungesättigte Fettsäuren erhöhen die Membranfluidität (“Knick” durch cis-Doppelbindungen stört die Packung
- Sphingolipide vermindern die Membranfluidität (durch gesättigte Fettsäuren und trans-Doppelbindungen im Sphingosin)
- Cholesterol moduliert die Membranfluidität (Erhöhung und Verminderung möglich)
Lipid rafts [Definition, Arten, Struktur, Funktion]
Mikrodomänen in Biomembranen, die sich hinsichtlich ihrer chemischen Zusammensetzungen und ihrer Funktionalität von den umgebenden Bereichen unterscheiden
Arten:
- Caveolae (Cholesterol-reich)
- GEM (Glycosphingolipid reich)
- PIP2-reich
Struktur:
- reich an Chol, SM (Sphingomyelin) und gesättigten FS
- Bereiche mit geringer Fluidität
- reich an funktionellen Proteinen
- Verbindungen zum Zytoskelett
bedeutsam für die Signaltransuktion (GEM, PIP2), Cholesteroltransport (Caveolae), Immunregulation und Pathogenese (zB M. Parkinson)
Freie Diffusion über biomembranen
ungehindert:
- CO2, N2, O2, Ethanol
- zT: Wasser und Harnstoff (wegen der hohen Wasserkonzentration in biologischen Systemen ist der unkontrollierte Nettofluss von Wasser relativ groß -> regulation des Wasserlusses durch Aquaporine)
wird gehindert:
- K+,Na+, Ca2+, Cl-, HCO3-, HPO42-
- Aminosäuren, proteine, Nukleinsäuren
Carrier-vermittelte Diffusion
Carrier (zB Ionencarrier) sind Transportenzyme, die die Aktivierungsenergie zB der Ionendesolvatisierung herabsetzen
Membrantransportproteine
- Transporter: Substrat wird durch Membran geleitet
- Rezeptor: Ligand bindet Extrazellulär -> intrazellulär wird ein Substrat (zB aus der membran) zu einem Produkt gespaltem
- Kanal: extrazelluläre Ligandenbindung -> Ion wird durch Membran geleitet
Richtung des Membranstransportes
- Uniport (I)
- Cotrasnport
- Symport (II)
- Antiport (III)
BeispieL: K+-Na+-ATPase (P-Typ): 3 Na nach innen + 2 K nach außen, gegen das Konzentrationsgefälle -> ATP -> ADP+ P (Antiport(direkt Energie-abhängig))

DIe 3 Domänen nennen
BACTERIA
ARCHAEA
EUKARYOTA
Merkmale Prokaryoten Bacteria
DNA im Zellkern (Nein)
Nucleosomen (Nein)
Membranbegrenzte Organellen (Nein)
Zytoskelett mit Motorproteine( Nein)
Ribosomen (70s)
Start-Aminosäure der Translation (Formyl Met)
Cycloheximid- sensitivität (Nein)
Erythromycin- sensitivität (Ja)
Merkmale Prokaryoten Archaea
DNA im Zellkern (Nein)
Nucleosomen (Halb)
Membranbegrenzte Organellen (Nein)
Zytoskelett mit Motorproteine( Nein)
Ribosomen (70s)
Start-Aminosäure der Translation (Met)
Cycloheximid- sensitivität (Nein)
Erythromycin- sensitivität (Nein)
Merkmale Eukaryoten
DNA im Zellkern (Ja)
Nucleosomen (Ja)
Membranbegrenzte Organellen (Ja)
Zytoskelett mit Motorproteine( Ja)
Ribosomen (80s)
Start-Aminosäure der Translation (Met)
Cycloheximid- sensitivität (Ja)
Erythromycin- sensitivität (Nein)
Endosymbiontentheorie
Aufnahme aerober Bakterien (Purpurbakterien) als Vorgänger der Mitochondrien
Aufnahme photosynthesierender Bakterien (Cyanobakterien) als Vorgänger der Chloroplasten
Indizien zu der Endosymbiontentheorie
DNA von Mitochondrien und Chloroplasten ist zirkulär, ohne hochrepetetive Sequenzen
70S–Ribosomen
Die Translation beginnt mit Formylmethionin
Enden der mRNAs: kein Kappe am 5’-Ende und keinen Poly-A-Schwanz am 3’-Ende.
Innere Membran des Mitochondriums ähnelt der eines Bakteriums: Fehlen von Cholesterin
Plasmamembran [Funktion]
Rezeptoren; Kanäle -> Import und Export von Molekülen.
Zytosol [Funktion]
Glykolyse, Gluconeogenese, Proteinbiosynthese, Intermediärstoffwechsel
(Synthese und Abbau von Nukleotiden oder Aminosäuren). pH 6,9 – 7,4
Rauhes endoplasmatisches Retikulum [Funktion]
Ribosomale Synthese von Proteinen für
- Export (Sekret)
- Plasmamembran
- Lysosomen,
- ER selbst.
Disulfidbrückenbildung / Tertiärstruktur/ Hydroxylierung von Lysin u. Prolin. Spezifische Proteolyse (Antigene)
Glattes endoplasmatisches Retikulum [Funktion]
Synthese von Lipiden (Triglyceride und Phospholipide; Cholesterin; Steroide; Prostaglandine). Hydroxylierungen (Oxygenasen/P450)
Golgi-Apparat [Funktion]
Modifizierung (O-Glykosylierung) von Proteinen; Sortieren von Proteinen. Synthese von Proteoglykanen (Extrazellularmatrix). pH 6,6
Endosomen [Funktion]
Intrazellulärer Transport von durch Endozytose aufgenommenen Molekülen
Lysosomen [Funktion]
Zerlegung von endogenen oder durch Endozytose aufgenommenen Makromolekülen (abbauende Enzyme mit Optimum bei pH 4,5 – 5,0)
Peroxisomen [Funktion]
ß-Oxidation (sehr langkettige FS/Cholesterin zu Gallensäuren); Reaktionen mit Beteiligung von Oxidasen, Peroxidasen und Katalasen. pH 6,9 – 7,1
Mitochondrien - äußere Membran [Funktion]
“Schutzbarriere”. Membrankanäle
Mitochondrien - innere Membran [Funktion]
Atmungskette; ATP-Synthese; Transport-Systeme
Mitochondrien - Matrix [Funktion]
ß-Oxidation; Citratzyklus; Teil des Harnstoffzyklus
Zellkern (Nucleus) [Funktion]
DNA-Synthese; Transkription; Spleißen. Gen-Regulation. Ribosomale Untereinheiten (Nucleolus). Kernporen zum Import und Export;
evolutionären Vorteile eines Zellkerns [Funktion]
Ohne Zellkern: 1 Gen = 1 mRNA = 1 Protein
Mit Zellkern:1 Gen durch Spleißen = mehrere mRNA = mehrere Proteine
Außerdem gibt es mit dem Zellkern einen zusätzliche Regulationsfaktor → spezifische Synthese von Stoffen
Typische Ionenkonzentrationen an der Zellmembran
Außen: K+ 5mM, Na+ 150mM, Cl- 120mM
Innen: K+ 150mM, Na+ 15mM, Cl 20mM, geladene Proteine 120mM
Was passiert wenn es einen Konzentrationsunterscheid gibt und alle Teilchen sich durch eine omnipermeable membran gleich gut verteilen können?
Teilchen diffundieren entlang des Konzentrationsgradients
dynamisches Gleichgewicht
Wie entsteht das elektrische Potential an der Zellmembran?
Plasmamembran ist semipermeabel d.h die Moleküle können sich nicht einfach so verteilen.
Nicht für alle Ionen durchlässig (hauptsächlich für K+)
Zellmembran innen: negativ geladen
Zellmembran außen: positiv
Gleichgewicht zwischen chemischem und elektrischen Potenzial
chemische Potenzial treibt K+ entlang des Konzgradienten nach außen
elektrisches Potenzial treibt die K+ nach innen
Netto im Ruhezustand chemisch=elektrisch
Elektrochemisches Potenzial = 0
Unterschied zwischen dem berechnenten (Nernst-Gleichung) und dem gemessenen Ruhepotenzial?
Die Zellmembran ist nie ganz dicht
Es können auch Na+ Ionen diffundieren
Wofür die Na+ -K+- Pumpe?
Die Membran ist nie ganz dicht, Na+ kann eindringen -> das Ruhepotenzial würde zusammenbrechen
Na+-K+-Pumpe hält das Ruhepotential aufrecht
Nernstgleichung
Berechnung des Ruhemembranpotentials
R=Gaskonstante
T=Temperatur
z= Ladung
F= Faraday Konstante (elektrische Ladung pro Stoffmenge)

Mukosviszidose (Cystische Fibrose(CF)) [Ursache]
- Mutation im Cystic fibrosis Transmembrane Conductance regulator (CFTR)-Gen auf dem Chromosom 7
- über 1800 CFTR-Mutationen bekannt (häufigste in Mitteleuropa: F508del)
- autosomal-rezessiver Erbgang
- Häufigkeit ~1:2500 in Europa
- Gendefekt -> Defekt des CFTR-Proteins -> vollständiger/teilweiser Funktionsverllust/ keine keine Membraneinlagerung/keine feste Membranverankerung -> verminderte Cl--Resektion/Sekretion -> zäher Schleim/ salziger Schweiß
Typische Symptome Mukoviszidose (90-95%)
- schwere CFTR Mutation (Klasse I -III)
- Schweiß Cl>60
- Nasenpolypen
- Leberzirrhose
- Exokrine Pankreasinsuffizienz -> Verdaustörung/ Blähbauch
- -> Diabetes Typ III
- Mekoniumileus (Darmverschluss)
- Lebenserwartung 38 Jahre
- Männlich Infertilität
- Bronchiektasen
- Auftreten im frühen Kindesalter
Atypische Symptome CF (5-10%)
- milde CFTR Mutation (Klasse IV-V)
- Schweiß Cl <60
- mildere sinopulmonale (Nasennebenhöhlen) Symptome
- Exokrine Pankreasinssufizienz
- Rez. Pankreatiden
- Präsentation späteres Alter
Therapie CF
- Infektionsprophylaxe, Antibiotika
- tägliche Physiotherpie
- Inhalation (DNAse, 5,85% NaCl)
- Bronchospasmolytika
- Entzündungshemmer (Steroide)
- O2
- (Lungentransplantation)
- Pankreas-Enzymsubstitution
- kalorien- und fettreiche Nahrung
- Vitaminersatzgabe
CFTR-Protein
intergraler, cAMP-regulierter Chloridionenkanal
in der Lunge: durch Chloridsekretion gelangt Flüssigkeit mit aus der Zelle -> Schleimfilm in der Lunge
viel in exokrinen Organen (Pankreas, Leber, darm, …)
auch in Schweißdrüsen -> Chloridrückresorption -> kein hoher Chloridverlust durch Transpiration
Mutationsklassen CFTR
Man unterscheidet fünf Mutationsklassen:
- ** 1. Klasse:** keine Proteinsynthese, da Mutation richtiges Spleißen verhindert
- 2. Klasse: Protein kann nicht im endoplasmatischen Retikulum reifen
- 3. Klasse: Protein reift und erreicht Zielmembran, jedoch fehlende Funktion als Chloridkanal
- 4. Klasse: Protein ist in die Zielmembran eingebaut, hat aber abnormale leitende Eigenschaften
- 5. Klasse: Bildung einiger funktionsfähiger Proteine
Klassen 1 bis 3 sind schwere Mutationen, während 4 bis 5 zu den leichten Mutationen zählen – hier ist die Funktion des Kanals nicht vollständig gehemmt.
Phase
räumlicher Bereich mit chemisch und physikalisch homogener Zusammensetzung
Phasengrenze
Fläche zwischen zwei Phasen
zB zwischen Luft und Flüssigkeit oder zwischen zwei nicht mischbaren Flüssigkeiten (Wasser/Öl)
Oberfläche
Phasengrenze zwischen einer festen bzw flüssigen und einer gasförmigen Phase
hydrophober Effekt (=hydrophobe “Wechselwirkung”)
- Zusammenlagerung hydrophober Moleküle bzw hydrophober Molekülbereiche in wässriger Lösung
- Ursache: Verringerung der Kontaktfläche zwischen Wasser und hydrophoben bereichen
- -> Zunamhe der Entropie (ΔS) des Wassers (vgl Gibbs-Helmholtz-Gleichung: ΔG=ΔH - TΔS)
- wichtig für
- Faltung von Proteinen
- Bildung von Mizellen und Lipiddoppelschichten
Wirkung von ampiphilen Substanzen auf Oberflächen
sind oberflächenaktiv (=senken die Oberflächenspannung)
-> Bildung eines Monolayers an der Grenzfläche Wasser/Luft (zB Surfactants in der Lunge
Mizellen
kugelförmige Bildungen von Carbonsäuren und Detergentien
im hydrophoben Inneren können hydrophobe Substanzen “gelöst” werden

Emulsion
fein verteiltes Gemisch zweier nicht mischbarer Flüssigkeiten
zB Milch, Mayonnaise, Salben
Emulgator
- ampiphile Substanz, die Emulsionen stabilisiert
- natürlich Emulgatoren
- Fettsäuren
- Phospholipide (emulgieren Fett im Blut (-> Lipoproteine)
- Gallensäure (emulgieren Fett im Darm)
Liposom
Phospholipid (zylinderförmig) bilden Doppelschicht (bilayer)
Lipidvesikel (=Liposom) umschließt wässriges Kompartiment

Surfactant
= surface active agents = grenzflächenaktive Substanz
besteht aus einer Mischung aus Phospholipide und Proteinen
von Pneumozyten Typ II gebildet
Funktion:
- Senkung des Eröffnungsdruck kleiner Alveolen und Vermeidung der gasumverteilung in große Alveolen
- Erhöhung der Lungen Nachgiebigkeit (Compliance)
- Verhinderung des endexpiratorischen Alveolarkollaps
Freisetzung von Signalmolekülen aus Biomembranen
Hydrolyse der Esterbindungen durch spezifische Enzyme (Phospholipasen)
Phospholipase C: Spaltung Phospholipid zB in Inositoltrisphosphat (IP3) und Diacylglycerol (DAG
Phospholipase A2: Abspaltung von Arachidonsäure, das bevorzugt an die zweite Bindungsstelle des Glycerol bindet

Lipid-Anker
Verankerung auf der cytosolischen Seite der Mebran
- durch Acetyl-Anker
- durch Isoprenyl-Anker (4x-Isopren: Geranylierung; 3x: Farnesylierung)
Verankerung auf der extrazellulären Seite der Membran
- GPI-Anker (Glykosyl-Phosphatyl-Inositol-Anker)
- Transamidase im ER-Lumen
- Transport zur Plasmamembran
Co-translationale Insertion in das ER
Signal recognition Particle (SRP) bindet an Signalpeptid -> Translationsstopp -> bringt und bindet an SRP Rezeptor an der rauhen ER Membran -> translation wird fortgeführt -> synthetisiertes Peptid wird durch ein Proteintranslocator in das ER Lumen gebracht

Einbau eines Proteines in die ER-Membran
zusätzliche hydrophobe Stop-Transfer-Sequenz
signalpeptidase spaltet spaltet Signalpeptid des proteins ab
Translocatorprotein öffnet lateral -> hydrophober Bereich verbleibt in der Mebran und verankert es dort
Chaperon
- Hitzeschockprotein (heatschock protein, hsp)
- erkennen und binden hydrophobe Bereiche
- verbrauchen ATP bei Faltung von Substratproteinen
- konkurrieren mit dem Proteasom
- Hsp60 (=Chaperonine): fassartige Struktur, die proteine vollständig aufnehmen
- Hsp70(zB BiP) binden bereits an das wachsende Polypeptid

Qualitätskontrollen von Proteinen
per Zuckerrest
Glykoprotein-bindende proteine (Lektine) haltem ungefaltete Proteine im ER fest (Calretikulin (luminal), Calnexin (membrangebunden)
Glucosyltransferase entscheidet, ob das protein richtig gefaltet ist
Vorteile von Glykoslierungen von Proteinen
- 50 % aller eukaryotischer Proteine sind glycosyliert
- Resistenz gegen Proteasen
- Schutz vor Erregern
- Förderung der Proteinfaltung
- Qualitätskontrolle der Faltung
Abbau von Proteinen [Warum?, Wie?]
WARUM?
- Defekte
- Alterung von Proteinen
- Phagocytose (Mikroorganismen)
- Autophagie (Organellen)
- Antigen-Prozessierung (MHC-I/MHC-II)
WIE?
- Lysosomen
- Ubiquitin-Proteasom-System (UPS)
- Caspasen
- Signalpeptidasen
- Prohormon-Convertasen
Reifung von Proteinen - Disulfidbrücken
- an Ausbildung des korrektes Faltungs- zustands auch kovalente Wechsel- wirkungen beteiligt
- Stabilisierung der korrekten Tertiärstruktur
- Enzyme: Protein-disulfid-isomerasen (PDI) -> Beschleunigung

Abbau von Membranproteinen
Abbau im Lysosom durch Cathepsine
- Abbau zellulärer Abfälle
- durch Endocytose / Autophagie / Phagocytose ,ins Lysosom
- Abgabe der Abbau- produkte über Membran
durch Ubiquitin-Proteasom-System
Ubiquitinsystem wählt Zielproteine aus und markiert diese für den Abbau, durch Anbauung von Polyubiquitinketten durch E1, E2 und E3-Enzyme
Proteasome bauen diese markierten Proteine ab
sekretorischer Weg
Protein-Synthese -> Proteinsynthese an freien Ribosomen im zytosol oder im ER (nur bei N-terminalen Signalpeptiden) -> cotranslationale Insertion in das Lumen des ER -> Qualitätskontrolle: richtige Faltung -> wenn ja: entweder Verbleib im ER oder Export in den Golgi-Apparat mit anschließender Sekretion in EZ
auf dem gesammten Weg wird das Protein weiter modifiziert und so für den Zielort bestimmt

Hämatoxylin-Eosin (HE)-Färbung
im sauren Milieu positiv geladene Metall- (z.B. Aluminium) Hämatein-Komplexe an die negativ geladenen Phosphatreste der Zellkern-DNA
Zellkerne und Ribosome färben sich durch ihren Nukleinsäuregehalt blau, die zytoplasmatischen Proteine rötlich
grampositiv unter dem Mikroskop
blau gefärbt nach Gramfärbung
Eigenschaft zu Sporenbildung

gramnegativ unter dem Mikroskop
Bei gramnegativen Bakterien ist eine Extraktion des Farblackes mit Alkohol
leicht möglich (werden farblos)
immer gramnegativ sind
- Bakterien ohne Zellwand
- Bakterien mit defekter Zellwand
- absterbende Erreger
Sporenbildung unter dem Mikroskop
Innerhalb der Bakterienzelle bildet sich ein rundovaler meist glatt begrenzter Bereich mit höherer Lichtbrechung. In der Gramfärbung macht sich der Bereich als runde Aufhellung bemerkbar
sonst meist grampositiv
Kokken unter dem Mikroskop
Im Präparat rund und in Trauben (Staphylo-) oder Ketten (Streptokokken) gelagert
Stäbchen
Stäbchenform
Auflösung bei einem Lichtmikroskop
dmin = kleinster Abstand, der noch getrennt wahrgenommen werden kann, λ = Wellenlänge des Lichtes und NA = numerische Apertur
Öffnung der Kondensorblende erhöht auch die Auflösung, verringert allerdings Kontrast und Tiefenschärfe

Größenverhältnisse von eukaryontischen Zellen, Zellorganellen und Mikroorganismen
Bakterien 1-10μm
Viren 0,02-0,3μm
Erythrozyten 5-10 μm
Kugelbakterien (Kokken) 1-5 μm
Zellkern 5-16 µm
Mitochondrien 0,5–1,5 µm
Zytose und vesikulärer Transport Möglichkeiten
- Phagozytose = für große, feste Teilchen; auch al Oberbegriff
- Pinozytose = unspezifisch, Flüssigkeit
- Endo- und Exozytose = rezeptorvermitteelt
- Transzydose = transzellulärer Transport
Transportproteine
integrale Membranproteine.
Zwei Sorten: Kanäle und Carrier (plus Sonderform der Carrier: Pumpen)
gating (Eigenschaft nur von Kanälen)
Die meisten (aber nicht alle) Kanäle können ihre Durchlässigkeit sprunghaft zwischen offen und geschlossen bzw. inaktiviert variieren
Kein schnelles gating haben
- Wasserkanäle (Aquaporine)
- Kanäle in den Schlussleisten zwischen Epithelzellen (Claudine)
voltage gate
zB der spannungsgesteurte Natriumkanal

ligant gate
zB bei Acetylcholin oder anderen Botenstoffen
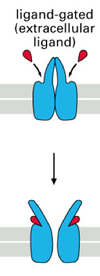
mechanically gate
zb bei Mechanorezeptoren

Eigenschaften von Carriern
- stöchiometrisch fassbare chemische Reaktion Konformationsänderung des Carriers bei jedem Durchtritt zu keinem Zeitpunkt komplett durchlässig
- kein gating
Uniporter

Symporter

Antiporter

Flusskopplung
In Symportern ist es möglich ein Substrat gegen den Gradienten zu transportieren, wenn er mit einem Molekül zusammen durch die Membran transportiert wird welches entlang des Grandients fließt
zB bei SGLT 1 und 2
Begriffe: Passiver / aktiver Transport
passiv immer bergab
aktiv kann bergauf erfolgen
passiv Transport
Kanal, Uniporter oder Lipidphase der Zellmembran
Antrieb: physikalische Kräfte
- Konzentration + elektrische Spannung -> elektrochemischer Gradient -> Diffusion
- Druck -> Filtration
aktiver Transport
primär: Pumpe,ATP(Antrieb)
sekundär: Symport/Antiport, primär aktiver Transport(Antrieb)
tertiär: Symport/antiport, sekundär aktiver Transport(Antrieb)
Primär aktiver Transport
definitionsgemäß unter unmittelbarem Verbrauch von ATP
Sekundär aktiver Transport
Carrier-vermittelter Symport oder Antiport, dessen Antrieb ein Ionengradient für Na+ ist.
Gradient->durch primär aktiven Transport (Na+/K+-ATPase) aufrechterhalten
Tertiär aktiver Transport
Antrieb durch sekundär aktiven Transport.
ATPasen
Pumpen = ABC-Transporter (ATP binding cassette)
Na+/K+-ATPase
H+/K+-ATPase
Pgp (P-glycoprotein) = ABCB1 = MDR1 (Multi drug resistance)
P-Glycoproteine
verhindert effizient die Passage von toxischen Substanzen in sensible Organe, reduziert dadurch die Absorption und demzufolge die Wirksamkeit von Arzneistoffen.
P-Glykoprotein (ABCB) Wirkung
- Zytostatika werden durch die P-gp-Pumpe aus der Tumorzelle ausgeschleust
- Antibiotika werden durch die P-gp-Pumpe aus dem Bakterium ausgeschleust
- Neurotoxine werden durch die P-gp-Pumpe aus den Gehirnzellen über die Blut-Hirn-Schranke in den Blutkreislauf zur metabolischen Entsorgung ausgeschleust (siehe Loperamid).
- Arzneimittel können bei oraler Applikation auf Grund der Affinität zu der Effluxpumpe eine verminderte Bioverfügbarkeit aufweisen.
- Ist bei allen Menschen unterschiedlich ausgeprägt (genetische Variante): Wenn Efflux-Transporter zu dominant gibt es zwei Alternativen:
- Dosis so erhöhen, bis gewünschte Wirkung eingestellt ist
- Behandlung des Efflux-Transporters (dann werden wird wieder geringe Dosis benötigt)
Pharmakokinetik (LADME-Schema)
Liberation= Freisetzung des Arzneistoffes aus der Applikationsform
Absorption = Resorption des Arzneistoffes
Distribution = Verteilung im Organismus
Metabolism = Verstoffwechslung vorwiegend durch Enzyme
Excretion = Ausscheidung aus Organismus
Arzneimitteltransporter
Uptake-Transporter
Efflusx-Transporter
Uptake-Transporter
Organischer Kationen-/ionentransporter
Transport von:
- endogenen Stoffen
- Arzneistoffen
- Modellsubstraten (körperfremde)
Efflux-Transporter
P-glycoprotein (ABCB) Familie:
(Multidrug Resistance Protein 1 (MDR1), Bile Salt Export Pump (BSEP, Multidrug Resistance-associated (MRP, ABCC) Protein Familie,Breast cancer Resistance Protein (BCRP, ABCG))
Diffusionsgesetz: 1.Ficksches Gesetz
J = -D * A * (Δc/d)
- Δc: Konzentrationsdifferenz
- A: Fläche
- D: Diffusionskoeffizient
Michaelis-Menten-Modell
beschreibt die Kinetik von Enzymen
Km: Michaeliskonstante ( Km gibt die Substratkonzentration an, bei der die Umsatzgeschwindigkeit halbmaximal ist)

Elektrische Äquivalenzgleichung
EM= (EK * GK + ENa * GNa+ GCl)/(GK+GNa+GCl)
E= Elektrochemisches potential für eine ionensorte (Nernst-Gleichung)
G= Leitfähigkeit einer Ionensorte
Lokalanästhesie
Örtlich begrenzte, reversible Ausschaltung von Schmerzrezeptoren bzw. entsprechen sensiblen afferenten Nervenfasern
Lokalanästhetika
entfalten ihre Wirkung an peripheren Nerven in dem sie die Natriumkanäle reversibel blockieren (kein Aktionspotential)
sind basische Amide (pKS= 7-9) -> können nur in deprotonierter Form durch die Zellwand dissoziieren, intrazellulär dissozieren sie dann und liegen in geladener Form vor in der Sie dann auch nur ihre Wirkung entfalten können

Acetylcholin-Rezeptor
= Transmembranrezeptoren, die als Substrat den Neurotransmitter Acetylcholin binden. Abbau des ACh durch Cholinesterase
Zwei Typen:
- Nicotinerg
- Direkte kopplung ans Na+-kanal
- Skelettmuskulatur, Neuronen des ZNS
- Muscarinerg
- indirekte Aktivierung zB von K+-Kanälen
- Parasympathikus, Herzmuskel, glatter Muskel, Drüsengewebe; Neuronen des Zentralen und peripheren Nervensystems
GABA-Rezeptor
γ-Aminobuttersäure-Rezeptor
wirchtigste inhibitorische Rezeptor im ZNS (30% der gesamttransmittermenge)
im Thalamus: Einleitung und Aufrechterhaltung des Schlafes
Modulatoren: Alkohol, Benzodiazepine (angstlösend, zentral mukelrelaxierend, sedierend, hypnotisch)

Protonenpumpenhemmer
zB Omeprazol:
Prodrug, das in den Belegzellen des Magens druch die den niedrigen pH Wert in die eigentliche Wirkstoff gewandelt der die protonen-Kalium-ATPase irreversibel hemmt und so kommt es zu einer Verminderung der magensäurekonzentration im magen (pH steigt an)



