Termoquímica e Cinética Química Flashcards
(61 cards)
Química: Termoquímica e Cinética Química
Termoquímica
Os processos de troca de calor com o meio externo podem ser…
Endotérmicos ou exotérmicos.

Química: Termoquímica e Cinética Química
Um processo _______ (endotérmico/exotérmico) envolve absorção de calor.
Endotérmico.
Química: Termoquímica e Cinética Química
V ou F?
Em equações termoquímicas, a quantidade de calor é descartada da reação.
Falso.
Em equações termoquímicas, a quantidade de calor é integrada a reação.
Química: Termoquímica e Cinética Química
Processos exotérmicos
Definição?
Processos em que ocorre a liberação de calor.

Química: Termoquímica e Cinética Química
Entalpia
Definição?
Conteúdo total de energia (calor) em um sistema.
Química: Termoquímica e Cinética Química
V ou F?
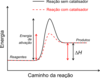
A variação de entalpia (ΔH) é a quantidade de calor medida, mesmo sob pressão variável, em uma reação química.
Falso.
A variação de entalpia (ΔH) é a quantidade de calor medida, sob pressão constante, em uma reação química.
Química: Termoquímica e Cinética Química
Variação de entalpia
Fórmula?
ΔH = Hprodutos – Hreagentes

Química: Termoquímica e Cinética Química
Caso a variação de entalpia apresente valor negativo, a reação é ________ (endotérmica/exotérmica).
Exotérmica.
Química: Termoquímica e Cinética Química
V ou F?
N2 + O2 → 2NOΔH = +43 Kcal
A equação acima é endotérmica.
Verdadeiro.
Química: Termoquímica e Cinética Química
Termoquímica
Quais fatores influenciam a troca de calor em reações químicas?
- Temperatura;
- Pressão;
- Estado físico;
- Estado alotrópico;
- Dissolução;
- Quantidade das substâncias.
Química: Termoquímica e Cinética Química
As chamadas equações de formação partem de reagentes com entalpia igual a ________ (zero/um).
Zero.
Química: Termoquímica e Cinética Química
V ou F?
Pressão e temperatura agem sobre as reações por meio da alteração do grau de agitação das moléculas.
Verdadeiro.

Química: Termoquímica e Cinética Química
V ou F?
A diminuição da temperatura em uma reação promove um aumento da quantidade de calor liberado.
Falso.
A diminuição da temperatura em uma reação promove uma queda da quantidade de calor liberado.
Química: Termoquímica e Cinética Química
Os processos de fusão e vaporização são _______ (endotérmicos/exotérmicos).
Endotérmicos.

Química: Termoquímica e Cinética Química
Termoquímica
Em ordem crescente, a entalpia de materiais sólidos, líquidos e gasosos é…
Sólido < Líquido < Gasoso.
Química: Termoquímica e Cinética Química
Substâncias alotrópicas apresentam entalpias _______ (iguais/diferentes).
Diferentes.

Química: Termoquímica e Cinética Química
Termoquímica
Ao fazermos a dissolução completa de uma substância, a variação de entalpia recebe o nome de…
Entalpia de solução ou calor de solução.
Química: Termoquímica e Cinética Química
V ou F?
A quantidade de energia liberada ou absorvida em uma reação é inversamente proporcional a quantidade de reagentes.
Falso.
A quantidade de energia liberada ou absorvida em uma reação é diretamente proporcional a quantidade de reagentes.
Química: Termoquímica e Cinética Química
Termoquímica
Calor de formação (ΔH0f) é…
Variação de entalpia envolvida na formação de 1 mol de dada substância, a partir dos seus elementos constituintes.
Química: Termoquímica e Cinética Química
Termoquímica
Calor de combustão (ΔH0comb) é…
Variação de entalpia ocorrida na combustão total de 1 mol de uma dada substância.
Química: Termoquímica e Cinética Química
Termoquímica
Calor de neutralização é…
Variação de entalpia ocorrida na neutralização de 1 mol de íons H+ com 1 mol de íons OH-.
Química: Termoquímica e Cinética Química
Termoquímica
Energia de ligação é…
Variação de entalpia ocorrida na quebra ou formação de ligações entre átomos.
Química: Termoquímica e Cinética Química
A energia de ligação é observada quando as substâncias estão no estado _______ (sólido/gasoso).
Gasoso.
Química: Termoquímica e Cinética Química
V ou F?
A quebra de ligações químicas ocorre com a liberação de calor.
Falso.
A quebra de ligações químicas ocorre com absorção de calor.