BLOCK 1: Cell- och vävnadslära Flashcards
Redogör för de Mendelska ärftlighetslagarna, bakomliggande mekanismer, dominant och recessiv nedärvning. X-bunden nedärvning, mitokondriell nedärvning.
- Mendel hittade olika versioner av “faktorer” - gener - som ligger bakom variation i ärftliga egenskaper. Dessa olika versoner av en och samma gen kallas alleler, och man får en allel av en gen från båda föräldrar - alltså en maternel och en paternel allel. Dessa två alleler kan vara samma (homozygot) eller olika (hetorezygot). Det är slumpmässigt vilken allel man får från mamman t.ex. då äggcell och spermier bär på en haploid (cell med 23 kromosomer) karotyp, alltså bara en allel av varenda gen.
- Om allelen är dominant räcker det bara med en sån för att utrycka allelens genotyp. När det gäller recessiva alleler måste både alleler vara recessiva för att uttrycka genotypet. I < 1% gener är den ena allelen tystat och bara den andra uttrycks.
- X-bundet nedärvning: gener ligger i X-kromosomen. Då män har bara en X kromosom, uttrycker de alltid genotypen av den allelen dem fått
- Kvinnor har två X-kromosomen, vilket betyder att genen i den andra allelen måste tystas. Det är slumpmässigt vilken kromosom som ska tystas i varje cell. När det gäller X-kromosombundna sjukdomar, kompeseras oftast med den X-bunda kromosomen, och kvinnor blir inte sjuka, utan är bara anlagsbärare. Mannen som bär på sjukdomsorsakande allelen i X-kromosomen däremot kommer även uttrycka genotypen, dvs insjukna.
- Mitikondrier har också sitt eget genom som kodar för 13 gener som alla deltar i andningskedjan. Mitokondrier och andra cellorganeller nedärvs alltid från mamman. då det inga cellorganeller i spermier. Mitokondriellt nedärvda sjukdomar nedärvs alltså alltid från mamman, aldrig från pappan - män alltså kan bli sjuka, men de kommer inte föra sjukdomsframkallande allelen/mutationen vidare. Mitokondriella sjukdomar visar också en varierande penetrans (sanolikheheten att bäraren får fenotypiska uttryck), då det är slupmässigt hur stor andel mitokodrier i äggceller som är muterade.
Trinukleotid repeats – anticipation (förväntan), genomisk inprintning
- Anticipation = barn drabbas i tidigare ålderar och svårare än äldrar. Det beror på att mutationen som ger upphov till sjukdomen ökar - expanderande trinukleotidupprepningar kan ge upphov till fenomenet, och består av tre baser som upprepas flertalet gånger. Ju fler upprepningar som finns, dessto mer framträdande blir symptomen. Efter att sjukdomen nedärvs kommer dessa områden med repeterade sekvener att öka. T.ex. Huntingtons (skador i nervsystemmet).
- Genomisk imprintning: bara en av de två allerlerna av en gen uttrycks, och den andra allelen tystas oftast med DNA-metylering, och andra epygenetiska mekanismer. Allelens ursprung bestämer oftast om den kommer att tystas eller inte - t.ex. genen som kodar för IGF-2 utrycks endast i den paternella allelen.
Normala cellers delningskapacitet är begränsad och i in-vitro kulturer observeras prolifrations-gränsen som “Hayflick limit” eller “Senesens crisis” dvs. cellerna växer inte mera. Vilka mekanismer känner man till som begränsar cellernas dellningförmåga och vilka celler in vivo kan tänkas påverkas av denna begränsning?
- Normala humana celler kan della sig ca 40-60 ggr, innan de når Hyflick limit och går i icke-replikativ senescence.
- DNA kan inte kopieras hela vägena till kromosomändarna, då avläsningar sker i 3’ => 5’ riktningen. För att kvarstående enkelstängat DNA inte skulle klippas bort, skyddas dessa bitar av telomerer. Telomerer i sin tur skyddas av protenier såsom shelterin. Telomererna kan förlängas av telomeras-enzymer, som är inte aktiva i normala vuxna celler. Därfor kommer telomererna succesivt kortas ner i takt med ökade antal celldelningar (= åldrande). Detta leder till senescens och cellcyckelstopp.
- Speciellt de tumörsuppresorgener som kodas av CDKN2A-locus verkar reglera senescence. CDKN2A kodar för tumörsuppressorproteiner p16/INK4A, vars uttryck korrelerar med åldern av vävnaden. p16 är en viktig regulator i övergången från G1 till S.
- Ackumulering av DNA-skador i cellen kan också ge upphov till senescence. Cellen försöker ju att reparera alla DNA-skador, och lyckas oftast med detta. Är skadan mycket allvarlig, går cellen istället i apoptos. Vid mellanting-skador går cellen istället i senescence genom aktivering av p53-tumörsuppresorn.
- Celler som begränsas av denna gränsning kan tänkas vara stamceller, vars minskande mängd ger upphov till cellfattighet och organskörhet (= åldrande).
- hematopoetiska stamceller → hos äldre bildas inte nya blodceller lika snabbt
- keratinocytstamceller → huden blir tunnare, sämre läkningsförmåga
- melanocytstamceller → förändring i hårfärgen
- färre satellitceller → muskelatrofi
Åldrande medför förändringar på flera nivåer i och utanför cellen. Vad händer med extracellulärmatrix och glykoproteiner? Hur påverkas DNA och genom? Övriga cellorganeller?
- Extracellulärmatrix: metylering- och modifiering- av ECM relaterade gener
- Glykoproteiner: Ackumulation av AGEs - advanced glycosylation end producuts. Sockerexponering glykerar proteiner och lipider. Inducerar skada genom crosslinking.
- DNA och genom: Förändring av metylerinsmönster och därmed genuttryck. Metyleringar i promotorregioner brukar öka, medan andra regioner hypometyleras. Detta leder till avstängning av gener, medan hela genomet blir mer ostabilt.
- Övriga cellorganeller:
- Lipofuscin ansamlas. Det utgörs av lipidinnehållande rester från lysosomal nedbrytning som ses som gulbruna pigment runt cellkärnor.
- Mitokondrier: MtDNAt har inte lika bra repareringsförmåga som nukleärt DNA, och därför ökar antalet mutationer med åldrande. Mutationerna ger bl.a. upphov till ökat läckage av fria syreradikaler → försämrad mitokondriefuntkion → hjärtarytmier m.m.
Metaplasi och dysplasi är två termer som beskriver förändringar i celltyp/morfologi. Redogör för dessa termers betydelse och ge exempel på tillstånd där metaplasier och dysplasier kan förekomma.
- Metaplasi: Förekomst av normala, mogna, differentierade celler av en annan celltyp, som normalt finns i vävnaden. Ett benignt tillstånd, där cellernas fenotyp förändras pga cellulärt stress, och är alltså reversibelt. T.ex. skivepiteldysplasi i bronker hos rökare, då retning av körtelepitelet ger upphov till skivepitelmetaplasi.
- Dysplasi: ett irreversibelt, pre-malign tillstånd. Förändrad cytologi i samband med ändrad vävnadsarkitektur. Kännetecknas ofta av förstorade cellkärnor, dålig organisation av celler, abnorm struktur, kromatinkondensering mm. T.ex cellförändringar i bronker - långvarig metaplasi ökar risken för dysplasi.
Vad kan vara orsaken till störningarna i stamcells/differentieringssystemen och hur kan stamceller och deras rekrytering påverkas så att metaplasi uppkommer.
- Ökad cellulär stress ger upphov till förändringar i stamcellsmognaden/differentieringen. Skivepitel tål mekanisk påfrestning bättre än körtelepitel. Därför differentierar körtelceller i bronkerna och cervix mm. till skivepitel vid ökad cellulär stress.
- Differentieringen regleras av faktorer som omkringliggande celler utsöndrar. T.ex. mognad och uppklättring av keratinocyter bestäms av fibroblastliknande celler, som producerar KGF, vilket stimulerar keratinocyter. Keratinocyter i sin tur medierar till fibroblaster mha IL-alfa och IL-beta. Ett tydligt exempel på en skadeinducerad stamcellsmognad kan ses i vävnadens regenerationsprocess i samband med skada, då fibroblaster aktiveras vid endotelcellskada och påbörjar sin proliferation. Vid endotelcellsskada sker utsöndring av tillväxtfaktorer, bl.a. PDGF.
Termerna hyperplasi, hypertrofi, atrofi och neoplasi beskriver tillstånd som har med celltillväxt, celldöd eller cellstorlek att göra. Förklara hur de olika termerna används och ge några exempel.
- Hypertrofi: ökad vävnadsvolym pga ökad cellstrolek. T.ex muskelväxt vid styrketräning.
- Hyperplasi: Ökad vävnadsvolym pga ökad cellantal. T.ex. erytrocyter på hög höjd; bröstkörtlar vid graviditet.
- Atrofi: minskad vävnadsvolym pga minskad cellstorlek eller minskat cellantal. Kan orsakas av cellatrofi, nekros eller apoptos. T.ex. muskelatrofi vid inaktivitet
- Neoplasi: benigna och maligna tillstånd som kännetecknas av okontrollerad celldelning och därmed nybildning av vävnaden. Det behövs en genetisk förändring som antingen stänger av en tumörsuppressorgen eller aktiverar en onkogen, för att cellen ska kunna dela sig okontrollerad. Maligna och benigna tumörer.
Patologer använder ofta begreppet atypi. Vad menas med detta och när används begreppet?
Atypi: “avvikande från det normala”. T.ex celler som har oregelbundna kärnor. Kan indikera tumörutveckling eller reaktiva tillstånd såsom inflammaton, kemisk retning eller retning av tillväxtfaktorer
De flesta celler i vävnader med en hög cellomsättning försvinner genom programmerad celldöd (apoptos). Vilka är huvudskedena i apoptosprocessen?
- Apoptos: Initiering sker antingen via en yttre eller inre väg.
- Yttre: ligandbindning till FAS-receptorn aktiverar FADD proteinkomplexet, som klyver och aktiverar caspas-1, vilket i sin tur klyver och aktiverar caspas-9. Grupp 1 kaspaser kallas för initiator kaspaser, som klyver och aktiverar grupp 2 kaspaser som kallas för executor kaspaser. Det blir en kaskadreaktion med kaspasaktiveringar, som till slut leder till att cellen krymper ihop sig, dör och fagocyteras.
- Aktivering av inre vägen sker vid ökad intracellulärt stress, som leder till att BAX-proteinerna släpper cytokrom c ur mitokondriet, som i sin tur leder till aktivering av caspas 9.
Vävnader och celler kan skadas på många olika sätt. Vilka skador kan man förvänta sig att hitta efter radioaktiv strålning - högdos och lågdos, värme, lösningsmedel, kyla, näringsbrist?
- Högdos radioaktiv strålning: DNA dubbelsträngsbrott
- Lågdos radioaktiv strålning: resulterar i fria radikaler, vilka i sin tur ger cross-linking av DNA-strängarna samt infästning av proteiner
- Värme: Essentiella enzymer och andra proteiner denatureras. Ökad metabol reaktionshastighet → substrat, vatten och pH-förändringar når dödliga nivåer. Lösningsmedel (t.ex. Xylene): lipidperoxidering→ mitokondrieskada → defekt andningskedjan
- Kyla: Hindrar blodflödet → ischemi; ger intracellulära kristaller som rupturerar cellmembraner
- Näringsbrist: glukosbrist → ATP-brist
Syrebrist är en av de vanligaste orsakerna till vävnadsskada och celldöd. Förklara mekanismerna bakom cellskada och celldöd som följd av syrebrist.
- Syrebrist ger skada fr.a. pga nedsatt ATP-produktion, vilket leder till försämrad membranintegritet då jonpumpar slutar fungera, och till sänkt pH då laktat bildas vid anaerob glykolys som startar för att ersätta energibristen.
- Defekta jonpumpar leder till en katastrofal frisättning av Ca2+ in till cellerna, vilket ger upphov till okontrollerad aktivering av enzymer såsom nukleaser och proteaser. Dessa börjar bryta ner bl.a. membranproteiner och nukleinsyror, vilket leder till nekros. Då läcker det ut substanser som fungerar som larmsignaler, vilka inducerar inflammation.
Vilka andra cellskadande agens finns?
Fria radikaler, kemikalier, mikroorganismer, immunologiska reaktioner, genetiska defekter, åldrande.
Hur fungerar cytostatika?
Cytostatika hämmar proliferation; de slår fr.a. på delande celler. Orsakar cellstress som aktiverar cellens eget apoptossystem, eller får tumörcellerna att gå i nekros. Cytostatika kan direkt hämma DNAt, indirekt hämma DNAt eller hämma mitosen i sig.
Cellen har flera stresshanteringssystem för att stå emot olika typer av stress/skador. Vad händer efter exponering för: syrebrist, värme, radioaktiv strålning, UV-strålning, ER-stress, virusinfektioner?
- Syrebrist: Anaerob glykolys
- Värme: Tillverkning av chaperoner, proteolys och nybildning av proteiner Radioaktiv strålning:
- UV-strålning: p53 inducerad reparation, senescence eller apoptos.
- ER-stress: Ökning av felveckade proteiner i ER leder till att global transkription och translation bromsas ner, medan några få specifika gener aktiveras, vars genprodukter kan rätta till de intierande problemen. Om detta inte fungerar utlöses apoptos via DDIT3.
- Virusinfektioner: Viruspartiklar binder till TLR-receptorer, vilket får virusinfekterade celler att börja producera interferoner (IFN-𝛂 och IFN-𝛃). Dessa binder till IFN-receptorer hos närliggande celler, vilket leder till cellcykelstopp och virusresistens.
Fria radikaler är samlingsnamnet på en rad reaktiva ämnen som i många fall uppstår i den normala metabolismen. Vilka skador kan fria radikaler ge på cellen och dess komponenter?
Fria radikaler är kortlivade reaktiva molekyler, som har oparade elektroner och är därför ständigt på jakt efter elektronrika områden, t.ex. vid bindningar mellan kolen i fettsyror där fyra elektroner delas på, samt bildningar i nukleinsyror, kolhydrater och proteiner. Dessa reaktioner kan vara autokatalytiska, vilket betyder att molekylen som attackeras omvandlas själv till fria radikaler, och kedjereaktionen fortskrider. Fria radikaler kan oxidera fettsyror och därmed störa cellmembraner; oxidera proteiner och försämra deras funktion och enzymatiska aktivitet; samt oxidera DNA och skapa mutationer och kromosombrott.
Vad händer i cellen när cellskadan övergår från att vara reversibel till att bli irreversibel? Patogenetiskt, ljusmikroskopiskt och elektronmikroskopiskt.
- Reversibla cellskador kan återställs, om den skadliga retningen avstår. Reversibel cellskada kännetecknas av minskad oxidativ fosforylering → tömning av ATP-förrådet; cellulärt ödem, och förändringar i cellskelettet och mitokondrier mm. Vid kontinuerlig retning blir skadan irreversibel, cellen kan inte längre hämta sig och dör antingen via nekros eller apoptos.
- Patogenetiskt: Nekros: defekta cellmembraner → läckage av bl.a. lysosomtatiska enzymer → nedbrytning av cellorganeller, läckage till omgivningen,
- Apoptos: fragmentering, ihopkrympning, fagocyteras.
- Ljusmikroskopiskt: förändringar kan ses efter 6-12 timmar; kärnorna försvinner, matrix finns kvar. Efter 24 h inträde av inflammatorisk celler.
- Elektronmikroskopist: förändringar kan ses efter 2-3 timmar. Fraktionerade membraner, dilaterade mitokondrier, intracellulära myelinkroppar, proteinaggregat
Hur skiljer sig apoptos från cell/vävnadsnekros, etiologiskt, patogenetiskt och morfologiskt? I vilka sammanhang spelar apoptos en viktig roll?
- Apoptos är en viktig skyddsmekanism vid DNA-skador som inte kan repareras. Då kan p53 inducera apoptos. Annars tar fysiologisk apoptos plats t.ex. i embryogenes, akuta inflammatoriska tillstånd samt eliminering av självreaktiva lymfocyter.

Vilka olika typer av vävnadsnekros känner du till och vid vilka olika tillstånd förekommer de?
- Koagulationsnekros. T.ex. vid myokardinfakrt. Cellerna stelnar, cellkärnor försvinner. Gangrän. Vid infarkt av extremitet → fylls med arteriellt blod som inte kan rinna tillbaka → en kraftig inflammation.
- Likvefaktionsnekros. I vävnad som saknar matrix ≈ hjärnan. Makrofager äter upp vävnaden → cystiska hålrum.
- Fettvävsnekros. Lokala områden av fettvävsdestruktion pga frisläppning av lipasenzymer från pancreas. T.ex. vid akut pankreatit.
- Ostig nekros. I princip endast i tuberkulos. Tuberkulosbakterier gömmer sig inne i makrofager → immunsystemet kapslar dem → jätteceller, presentation till T-celler. Fibrinoid nekros. Förekommer i blodkärl vid inflammatoriska sjukdomar. Autoantikroppar angripper kärlvägger, vilket leder till att fibrin läcker ut från blodbanan.
Hemosideros och hemokromatos: orsaker och skillnader. Vilken form är vävnadsskadande? Vilka vävnader drabbas främst och vad blir följderna?
Både är järninlagringskomplex, som bildas vid sönderfall av hemoglobin. Kan ses som ett gulbrunt pigment i vävnaden, ffa i makrofager i benmärgen, levern och mjälte.
- Hemosideros är lindrigare ansamling av järn, som endast förekommer i fagocyterande makrofager. Detta leder inte till parenkymskada, och kan orsakas av ökat järnintag, hemolys eller alkoholcirrhos.
- Hemokromatos är allvarligare; då ansamlas järn såväl i fagosyterande celler som i parenkymceller, fr.a. i levern. Det leder till parenkymskador i olika organ. Hemokromatos kan förekomma som en del av ärftlig syndrom eller som symptom i leverskada, diabetes mm.
Skillnader och likheter mellan lipofuscin, neuromelanin och melanin. Förekomst och betydelse?

Vad innebär metastatisk respektive dystrofisk förkalkning? Exemplifiera.
- Metastastisk förkalkning: Förkalkning i en i övrigt normal vävnad, beror på hyperkalcemi t.ex. pga bennedbrytning eller hyperparathyredoism. Kan ge upphov till njurstenar i njurar.
- Dystrofisk förkalkning: Förkalkning i döende vävnad. Återfinns i nekrotiska områden, t.ex. i skadade hjärtklaffar och aterosklerotiska kärl, där de orsakar förhårdnad.
Vad är antrakos – orsaker, lokalisation, morfologi? Hur påverkas vävnaderna?
- Inlagring av kolpigment. Kan ses t.ex. i lungan, då kolpartiklar som inhaleras tas upp av alveolarmakrofager och transporteras till regionala lymfnoder i det tracheobroncheala området. Hos kolgruvarbetare kan kolaggregat ge upphov till fibroblastisk reaktion och till och med emfysem.
Vad är amyloid biokemiskt? Hur definierar man sjukdomen? Vilka är de två viktigaste systemiska (extracerebrala) formerna av amyloidos – orsaker, beståndsdelar, vilka organ drabbas, symtom, prognos?
- Amyloid är abnormal inlagring av olösliga trådliknande fibriller, som består av proteinöverskott eller felveckade proteiner (95% fibriller, 5% komponent P och andra glykoproteiner). Felveckade proteiner bildas, digereras av makrofager och hamnar extracellulärt där de ligger i ”𝛃-pleated sheets”.
- Mekanismen bakom denna typ av amyloidos förklaras av att de felveckade proteinerna inte märks ut med ubiquitin och degraderas i proteasomer som de normalt ska göra, utan istället digereras av makrofager och hamnar extracellulärt.
- Amyloidos hittas nästan alltid systemiskt, men vissa former av amyloid faller endast ut lokalt i hud, stämband och thyroidea etc. Bl.a. hittas det lokalt i CNS i form av beta-amyloid i samband med hög ålder och neurodegenerativa sjukdomar.
- Viktigaste extracerebrala formerna är AL-amyloidos (A-amyloid, L-immunoglobulin light chain) och AA-amyloidos. AL-amyloidos består av lätta kedjor av antikroppar, som producerats av abnorma plasmaceller vid myelom mm.
- AA-amyloidos omfattar serum-amyloid A, som bildas vid kronisk inflammation, t.ex. RA. Drabbar fr.a. hjärta, njure och levern.
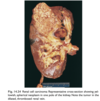
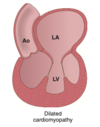
- Amyloidinlagringar kan ge upphov till restriktiv kardiomyopati → hjärtsvikt, nefrotisk syndrom → njursvikt.
- Kan leda till allvarliga komplikationer och även död. Första symptomen är ofta ospecifika, såsom svaghet, viktnedgång och yrsel. Genomsnittlig överlevnad är 2 år för AL-patienter, ännu sämre i myelomassocierade (benmärgcancer) fall.
Vilken är den cerebrala formerna av amyloidos – beståndsdelar, lokalisation, följder?
- 𝛃-amyloid. Bildas från amyloid prekursor protein i CNS. Fr.a. i hjärnans kärl i samband med hög ålder. Excessiv (omåttlig) ackumulering är patologiskt, och leder till neurodegenerativa sjukdomar.