Allgemein Flashcards
Isomerie
- Gleiche Summenformel
- Unterschiedliche Struktur (Atomanordnung)
Strukturisomere
(Konstitutionsisomere)
Gleiche Anzahl und Sorte von Atomen aber unterschiedliches Strukturformel
Mesomerie
e-paar beteiligt sich an Bindungen zwischen mehr als 1 Atom (Carbonation CO₃⁻²)
Grenzstruktur
Bier ⟶ Radler (Mesomere) ⟶ Limo

Funktionelle Gruppen
Atomgruppen die eine vergleichsweise hohe chemische Reaktivität haben, welche die Reaktivität des Moleküls mitbestimmt
Art der funktionellen Gruppen
Sauerstoff-, Stickstoff-, Sauerstoff und Stickstoff-, Schwefel-enthaltend
Kohlenwasserstoffe (KWs)
Verbindungen die nur aus Kohlenstoff und Wasserstoff bestehen
Gesättigte Kohlenwasserstoffe
- Alkane (Einfachbindungen) - Cycloalkane (Einfachbindungen und Ringe)
Ungesättigte Kohlenwasserstoffe
- Alkene (Doppelbindungen) - Alkine (3-Fachbindungen)
Aromatische Kohlenwasserstoffe
Cyclische KWs/Struktur von Benzol abgeleitet
Methan
Summenformel: CH₄ (1 C Atome) Strukturformel: CH₄ Strukturisomere: 1
Ethan
Summenformel: C₂H₆ (2 C Atome) Strukturformel: CH₃CH₃ Strukturisomere: 1
Propan
Summenformel: C₃H₈ (3 Atome) Strukturformel: CH₃CH₂CH₃ Strukturisomere: 1
Butan
Summenformel: C₄H₁₀ (4 C Atome) Strukturformel: CH₃CH₂CH₂CH₃ Strukturisomere: 2
Pentan
Summenformel: C₅H₁₂ (5 C Atome) Strukturformel: CH₃CH₂CH₂CH₂CH₃ Strukturisomere: 3
Nomenklatur der Alkane (IUPAC)
- Längste geradlinige C-Kette.
- Identifizieren und nennen Gruppen am Ketten verbindet
- Numerieren die Kette, damit den ersten Substituenten den kleinsten Nummer hat.
- Zeichnen die Substituenten an den richtigen Positionen ein
- Bauen den Namen zusammen, Substituenten in der alphabetischen Reihenfolge mit Suffix -yl.
PS: Präfixe (di-, tri-, tetra sind NICHT zu konsiderieren für die alphabetische Reihenfolge)
Cycloalkane (CnH2n)
Cyclopropane (C₃H₆); Cyclobutane (C₄H₈); Cyclopentane (C₅H₁₀); Cyclohexane (C₆H₁₂), usw.
Nomenklatur der Cycloalkane
- Finde die Hauptkohlenwasserstoffkette
- Nummeriere sodass Substituenten die kleinstmögliche Ziffer erhalten.
- Substituenten in alphabetischer Reihenfolge mit Ziffern und Vorsilben (di-, tri-, tetra-) vor den Namen. Cyclo- nicht vergessen)

Cis-isomere
- Substituenten auf der gleichen Seite des Rings
- NICHT in trans-Isomere überführbar

Trans-isomere
- Substituenten auf gegenüberliegenden Seite des Rings
- NICHT in cis-Isomere überführbar

Cis-trans-isomerie
- sind nicht ineinander überführbar;
- unterschiedliche physikalische/chemische Eigenschaften;
- können voneinander getrennt und aufbewahrt werden;
- kann von großer Bedeutung für die biologischen Eigenschaften einer Verbindung sein
Halogenierung der Alkane
Substitutionsreaktion: ein oder mehrere Atome des Alkans werden gegen Halogenatome ausgetauscht.
z.B. Chlorierung: CH₄ + Cl—Cl ⟶ CH₃Cl + HCl
Alkene
KWs die C=C Doppelbindung enthalten
Formel: CnH2n + H₂ ⟶ Alkan
Alkadiene; -triene; -tetraene; -polyene (Anzahl der Doppelbindungen)
Alkine
KWs die C≡C 3-Fachbindung enthalten
Formel: CnH2n-2 + 2H₂ ⟶ Alkan
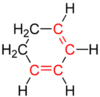
Isolierte Doppelbindung
isoliert - 2 oder mehr einfache Verbindungen entfernt von weitere Doppelbindungen