2 Elektrokjemi Flashcards
Redokspar

Et stoff som har sitt maksimale antall elektroner, vil vaere på sin reduserte form.
Hvis stoffet gir fra seg elektronene, vil det vaere på sin oksiderte form.
Disse to formene kaller vi redoksparet for stoffet.
Spenningsrekka viser oss en rekke stoffer, sortert etter evne til å ta opp elektroner.
Spenningsrekka
Spenningsrekka viser oss en rekke stoffer, sortert etter evne til å ta opp elektroner.

Metaller i vann

Metaller løses vanligvis ekstremt dårlig i vann. Noen partikler går ut i vannet, men det vil skje i en veldig liten grad.
Dette skjer ved at metallatomene går ut i løsningen som ioner, mens elektronene blir igjen på metallbiten.
Spenningsrekka
E0red
oksiderende evne
Jo høyere E0red Jo bedre til åta opp e-
Fra bildet sammeligne alle med H

Hva er edelmetaller

Edelmetallene er gull, sølv og platinametallene. De kalles «edle» fordi de ikke reagerer med oksygen og vann, og heller ikke løses i fortynnede syrer. I naturen forekommer de gjerne i fri tilstand.
Kvikksølv er et halvedelt metall. Aluminium, jern og sink er uedlemetaller.
Standard elektrodepotensial er et mål for metallenes edelhet. Jo høyere dette potensialet er, jo edlere er metallet. Gull er det edleste av alle metaller.
standard elektrodepotensial
Standard elektrodepotensial er innen kjemi det elektrokjemiske potensialet for elektrodereaksjoner med elektrolytter basert på vann som løsningsmiddel. «Standard» refererer til standardtilstand, som er rene forbindelser ved kjemisk aktivitet lik en.
Krav til en spontan redoksreaksjon:
- Vi må ett stoff på oksidert form (som kan ta opp e-),
og ett stoff på redusert form (som kan avgi e-) - Stoffet som skal ta opp e- må ha høyere E0red
enn stoffet som skal avgi e-. Hvis ikke klarer det
ikke å ta elektroner fra stoffet som skal avgi
dem.
to typer elektrokjemiske celler
- Galvaniske celler
- overgang fra kjemisk energi til elektrisk energi
- spontan redoksreaksjon
- batteri - Elektrolyseceller
- overgang fra elektrisk energi til kjemisk energi
- ikke-spontan redoksreaksjon
- brukes ofte til å renframstille stoffer, for eksempel metaller som ligger langt nede i spenningsrekka.
- ladning fylle i batteri
Elektrolytt
Et flytende stoff som inneholder ioner og derfor kan lede strøm (transport elektroner). Vanligvis er vandig løsning av et salt.
Kan også være en løsning av en syre eller en base, eller et smeltet salt.
Elektrode
Laget av et fast stoff som kan lede strøm(treansportere elektroner).
Oftestlaget av et metall eller grafitt
Inert elektrode
En elektrode som består av et materiale som ikke selv kan inngå i en redoksreaksjon. Vanlig inerte elektroder er av grafitt eller platina.
Katode
Elektroden hvor det skjer en reduksjon
Anode
Elektroden hvor det skjer en oksidasjon
Galvanisker celler

Galvaniske celler er vanligvis delt opp i to adskilte halvceller.
I den ene halvcella skjer det en oksidasjon, og i den andre skjer det en reduksjon
De to halvreaksjonene i redoksreaksjon skjer altså på hvert sitt sted.
Dette medfører at elektronene som avgis i oksidasjonen må vandre gjennom en elektrisk leder for å komme dit reduksjonen skjer.
Da oppstår det Elektrisk strøm!
Halvceller

En halvcelle består av en elektrode som står i en elektrolytt.
I en halvcelle har vi ofte både den oksiderte og den reduserte formen av et gitt stoff - vi har altså et redokspar der.
Vanligvis er dette en metallelektrode som står i en elektrolytt som inneholder ioner fra det samme metallet. For eksempel en kobbeelektrode som står i en Kobbersulfat løsning CuSO4(aq)
Når begge delene av redokparet er til stedet, så kan halvcellen benyttes både som katode og anode, avhengig av hva vi kobler den sammen med.
Daniellcella
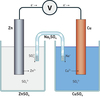
Daniellcella er et eksempel på en galvanisk celle
Den består av en sinkhalvcelle og en kobberhalvcelle.
Sinkhalvcella er en sinkelektrode i en sinksulfatløsning, ZnSO4(aq)
Kobberhalvcella er en kobberelektrode i en kobbersulfat løsning, CuSO4(aq)
3 faktorer som kan medføre at daniellcella slutter å gi strøm.
- Sinkstaven kan bli brukt opp. Da blir det ikke frigjort flere elektroner.
- Det kan også gå tomt for vobberioner. Da blir det ikke tatt opp flere elektroner.
- Saltbrua kan går tomt for ioner. Da vil ikke utlignet ladningforskjellene, og reaksjonene stopper opp.
Cellepotensialet
Cellepotensialet i en galvanisk celle er den elektriske spenningen som oppstår mellom de polene i cella.
Vi beregner cellepotensialet ut fra potensialene for halvreaksjonene.
E0red+E0oks=E0celle
ikke glemme å skiftenfortegn(t tabellen viser potensialet for reduksjonen)
Blyakkumulatoren

Blyakkumulatoren er en galvanisk celle som kan lades opp igjen, det er altså et oppladbart batteri.
Det er svært stabilt, og tåler svært mange oppladinger.
Dette er tradisjonelt batteritypen som blir brukt i biler.(ikke el-biler)
Batteriet har to store ulemper:
- Bly er et svært miljøskadelig tungmetall.
- Elektrolytten i batteriet er svovelsyre, og det er derfor risiko dersom batteriet lekker.
Den ene elektroden er av fast bly, Pb, og den andre av bly(IV)oksid, PbO2. Begge elektrodene står i samme elktrolytt av svovelsyre, H2SO4.
Fordi siden elektrolytten er den samme i begge halvcellene

Brenselcelle
En brenselcelle fungerer på mange måter som en galvanisk celle:
- Det skjer en spontan redokreaksjon som vi kan utnytte for å få strøm.
- Reduksjonen og oksidasjonen skjer på hver sitt sted, og elektronene kan vandre fra anoden til katoden gjennom en ytr leder.
Men det er en viktig forskjell: I en brenselcelle kan vi etterfylle reaktantene til redoksreaksjonen, og vi kan tappe ut produktene som dannes.
PEM-cella

En vanlig brenselcella er PEM-cella.
Det består og to kammer som er adskilt av en PEM.membran (Proton Exchange Membrane)
En membran kan slippe igjennom enkelte stoffer, men holde tilbake andre.
Membranen i PEM-cella er dekket av et platinagitter. Platina (og en del andre metaller) har den egenskapen at mange gasser lett adsorbere på overflaten av metallet.
Platina vil fungere som en katalysator i PEM-cella.
PEM-cella (2)
Hydrogenelektroden
I halvcellene vi har sett på så langt, har vi brukt redoksparene til metaller.
Da har vi en elektrode av metall som kan lede elektroner, mens vi har metallioner i elektrolytten.
Dersom vi skal lage en halvcelle med redoksparet til hydrogen, så får vi et problem. Hydrogen på redusert form er hydrogengass! Vi får ikke til å lage en elektrode som overfører elektroner av et stoff som er på gassform.
Som elektrolytt bruker vi 1M saltsyreløsning, HCl (aq).
Det gir oss H+-ioner, altså hydrogen på oksidert form, i elektrolytten.
Vi bobler hydrogen på redusert form, altså hydrogengass, H2 (g), gjennom elektrolytten. Da har vi redoksparet H+ / H2 tilgjengelig i halvcella
Vi bruker platina som elektrode. Platina er inert og vil ikke reagere selv.
Hydrogengass adsorberes på overflaten av metallet. Dermed er platinaet i kontakt med både hydrogengassen og hydrogenionene.
Hydrogenelektroden kan da brukes både som katode og som anode:
Katode: 2H+ + 2e- ⟶ H2
Anode: H2 ⟶ 2H+ + 2e-

Hvor for er Pt en god katalysator