VL-Stoff Flashcards
Viel Spaß
Wie können Alkene hergestellt werden?
Herstellung von Alkenen
- Eliminierung
- Dehydrierung (Speziallfall mit starken Katalysatoren)
- Saure Dehydratisierung von Alkoholen
Was ist eine elektrophile Addition AE?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
elektrophile Addition AE
- Alkene reagieren mit polaren Molekülen wie Br2, Cl2, oder anorganischen Säuren HX
- Entstehen Halogenalkane
Was kann mit Alkenen gemacht werden?
Reaktionen mit Alkenen
- Elektrophile Addition
Alkene e–-reich wegen Doppelbingung → reagieren gern mit Elektrophilen σ+
Was ist eine Eliminierung? Welche Mechanismen gibt es (kurz) und welche konkurrierende Reaktionen gibt es?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
Eliminierung
- Alkohole/Halogenalkane reagieren zu Alkenen
- Substituenten werden entfernt und DB entsteht
- Spezialfall: Dehydrierung (-H2, +Kat.)
- E1 (1,2 oder beta)
- E2
Begünstigt durch:
— sehr große Basen, die nicht als Nu reinpassen
— höhere t°
Welche konkurrierende Reaktionen gibt es bei der Eliminierung?
Konkurrierende Reaktionen
- E1 ↔ SN1
- E2 ↔ SN2
Eliminierung insgesamt durch höhere Temperaturen und sehr große Basen begünstigt
Welche konkurrierende Reaktionen gibt es bei der nukleophilen Substition SN?
Konkurrierende Reaktionen
- E1 ↔ SN1
- E2 ↔ SN2
Nukleophile Substitution wird insgesamt durch niedrigere Temperaturen und kleinere bis große Nukleophile begünstigt
Was ist die Markownikow-Regel?
— Bedingungen
— Art der Reaktion
— Bevorzugung
Markownikow-Regel
- assymetrische Alkene
- elektrophile Addition, regioselektiv
- 1,2-Eliminierung
- Halogenwasserstoffe H-X
Es werden höher substituierte Kationen bevorzugt, die
— durch +I
— durch sterische Abschirmung von R
besser stabilisiert sind.
Das Halogenatom wird dementsprechend an das wasserstoffärmere, also höher substituierte Kohlenstoffatom gebunden.
→ Δ1 Hofmann: großere Basen werden eher seitlich angreifen
→ Δ2 Zaitzew (höher substituiert): kleinere Basen können H besser abschirmen

Welche Grenzstruktur(-en) hat eine Carbonylgruppe?
Carbonylgruppe

Was ist Aromatizität?
— Summenformel
— Eigenschaften
Aromatizität
Hückel-Regel: 4n+2 π-Elektronen cyclisch konjugiert
Beispiel: Benzen hat 6 π-Elektronen → n = 1, konjugiert!
Kationen und Anionen können auch als Aromaten sein, freie Elektronen beachten.
Elektrophile Substitution an Aromaten SEAr
— Womit reagieren Aromaten
— Was entsteht
— Welche Bedingungen
— Verlauf der Reaktion
Elektrophile Substitution an Aromaten SEAr
- mit Säuren/Halogenen
- unter Katalysatoren (Lewis-Säuren ziehen zu sich e– und machen ein gutes Elektrophil⊕)
Verlauf der Reaktion
- Katalytische Ionisierung von Br2/Cl2/-NO2/-NO → E⊕
- π-Komplex mit E⊕
- E⊕ mit H an der Stelle → Kation mit 3 Grenzformen (gegenüber-unten-oben rechts) = σ-Komplex
- Abspaltung von H+ (Deprotonierung) + Rearomatisierung
- Mehrfache Substitution: +I/+M ortho- und para-, –I/–M meta

Nennen Sie Beispiele von stärken Elektrophilen.
Elektrophile E⊕
- polarisierte Halogene unter Einwirkung einer Lewissäure als Katalysator
- Carbokationen
- Carbonylverbindungen unter Einwirkung einer Lewissäure als Katalysator → ein Acylkation
- Nitrosylkation NO⊕ (Salpetrige Säure)
- Nitrylkation NO2⊕ (Salpetersäure)
- Schwefeltrioxid HSO3⊕(Schwefelsäure)
Koordination einer Lewissäure (Katalysator) an das negative Ende des Elektrophils verstärkt die Polarisierung der Bindung und beschleunigt die elektrophile Substitution.
Wie kann aus Benzen ein Methylbenzen gemacht werden?
Friedel-Crafts-Alkylierung
- Katalytische Ionisierung mit Lewis-Säure: H3C-Cl + AlCl3 → CH3⊕ + [AlCl4]⊖
- Doppelbindung aus dem Aromat greift -CH3⊕ an (π-Komplex)
- 3 Grenzstrukturen (σ-Komplex)
- Deprotonierung -H+

Was ist eine Friedel-Crafts-Alkylierung (Mechanismus, Reaktanten)?
Friedel-Crafts-Alkylierung
- Aromate + Alkylkatione mit Katalysator
- Elektrophile Substitution an Aromaten
Ablauf
- Katalytische Ionisierung mit Lewis-Säure: H3C-Cl + AlCl3 → CH3⊕ + [AlCl4]⊖
- Doppelbindung aus dem Aromat greift -CH3⊕ an (π-Komplex)
- 3 Grenzstrukturen (σ-Komplex)
- Deprotonierung -H+
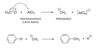
Welche Kationen können aus den folgenden Säuren entstehen (Strukturformel):
- Salpetrige Säure
- Salpetersäure
- Schwefelsäure
- Nitrosylkation NO⊕ (Salpetrige Säure)
- Nitrylkation NO2⊕ (Salpetersäure)
- Schwefeltrioxid HSO3⊕(Schwefelsäure)

Welche charakteristische Gruppen haben +M-Effekt?
+M-Effekt
- freies e–-Paar wird dem π-System hinzugefügt → e–-Dichte erhöht sich
- also alle Atome mit freien Elektronen
- ortho-/para-Stellung
–O−
–NH2
–NR2
–OH
–OR
–NH(CO)R
–O(CO)R
–(Aryl) (z. B. –Phenylgruppe)
–Br, –Cl, –I, –F

Welche charakteristische Gruppen haben –M-Effekt?
–M-Effekt
- e– werden aus dem π-System entzogen→ e–-Dichte erniedrigt sich
- also alle Gruppen mit Doppel- oder Dreifachbindungen → erschweren weitere Substitutionen
- meta-Stellung
–COOR
–COOH
–CHO
–(CO)R (Carbonyl-)
–CN (Nitril-/Cyanid)
–CH=CH–COOH
–NO2 (Nitro-)
–NO (Nitroso-)
–SO3H

Welche Stellung nehmen die Substituenten mit +M-Effekt bei mehrfachen Substitution (SEAr)? Nennen Sie dazu ein paar Beispiele.
+M-Effekt bei mehrfachen Substitution (SEAr)
- ortho/para-Stellung
- -O–, -NH2, -Cl

Welche Stellung nehmen die Substituenten mit –M-Effekt bei mehrfachen Substitution (SEAr)? Nennen Sie dazu ein paar Beispiele.
–M-Effekt bei mehrfachen Substitution (SEAr)
- meta-Stellung
- –COOH, –CHO, –NO2

Wie wirkt +M-Effekt auf die Reaktivität aus?
+M-Effekt
- freies e–-Paar wird dem π-System hinzugefügt → e–-Dichte erhöht sich
- also alle Atome mit freien Elektronen
- ortho-/para-Stellung
AKTIVIEREND → eventuelle elektrophile Zweitsubstitution wird dadurch begünstigt

Wie wirkt –M-Effekt auf die Reaktivität aus?
–M-Effekt
- e– werden aus dem π-System entzogen→ e–-Dichte erniedrigt sich
- also alle Gruppen mit Doppel- oder Dreifachbindungen
- meta-Stellung
DEAKTIVIEREND → erschwert weitere Substitutionen durch Erhöhung der Aktivierungsenergie

Wie wirkt –M-Effekt auf die Säurestärke aus?
Säurestärke beim –M-Effekt
WIRD ERHÖHT von aromatischen, aciden Verbindungen, da sie das entstehende Anion der Säure stabilisieren.

Wie wirkt +M-Effekt auf die Basenstärke aus?
Basenstärke beim +M-Effekt
- Aromat mit —NH2 (Aminogruppe), z.B.
- Elektronen in den Ring gedruckt
- → funktionelle Gruppe wird positiver
- pKb-Wert steigt = Basenstärke↓

Nukleophile Substitution an Aromaten SNAr
— Voraussetzungen
— Mechanismus
Nukleophile Substitution an Aromaten SNAr
- –I/–M-Substituent vorhanden
- gute Abgangsgruppe
Verlauf der Reaktion
-
Additions-Eliminierungs-Mechanismus
1. 2.
Welche Reaktionen können Alkohole einhergehen?
Reaktionen der Alkohole
- Als Säure (wenn starke Base dabei)
- Als Base (starke Säure dabei)
- Als Nukleophil (katalysiert mit Base + Nu-)
- Als Elektrophil (saure Katalyse)
Wie verläuft die Reaktion mit dem Alkohol als Säure und welche Voraussetzungen dafür?
Alkohol als Säure
- starke Base muss dabei sein
- Protonabgabe und Alkoholat-Herstellung
Verlauf der Reaktion
- Alkohol + starke Base
- Alkohol spaltet sich in ein Alkoholat-Anion und H+

Wie verläuft die Reaktion mit dem Alkohol als Base und welche Voraussetzungen dafür?
Alkohol als Base
- Reaktion mit starker Säure
- → Protonaufnahme und Oxonium-Kation

Wie verläuft die Reaktion mit dem Alkohol als Nukleophil und welche Voraussetzungen dafür?
Alkohol als Nukleophil
- Aus dem Alkohol muss ein starkes Nukleophil gemacht werden → Alkoholat durch H+-Abzug mit Base
- Nukleophiler Angriff vom Sauerstoff nach SN2 → Williamson-Ethersynthese
Je nach Struktur der Reste und Reaktionsbedingungen kann SN1/SN2 sein

Formulieren Sie die Reaktion von Williamson-Ethersynthese.
Williamson-Ethersynthese
- Alkohol + Alkylhalogen
Verlauf der Reaktion
- Aus dem Alkohol muss ein starkes Nukleophil gemacht werden → Alkoholat durch H+-Abzug mit Base
- Nukleophiler Angriff vom Sauerstoff nach SN2 → Ether + X-
- Je nach Struktur der Reste und Reaktionsbedingungen kann SN1/SN2 sein

Wie können Ether hergestellt werden?
Williamson-Ethersynthese
- Alkohol + Alkylhalogen
Verlauf der Reaktion
- Aus dem Alkohol muss ein starkes Nukleophil gemacht werden → Alkoholat durch H+-Abzug mit Base
- Nukleophiler Angriff vom Sauerstoff nach SN2 → Ether + X-
- Je nach Struktur der Reste und Reaktionsbedingungen kann SN1/SN2 sein
Wie können Halogenalkane hergestellt werden?
Herstellung von Halogenalkanen
- Radikalische Substitution
- Saure Katalyse von Alkoholen
3.
Wie verläuft die Reaktion mit dem Alkohol als Elektrophil und welche Voraussetzungen dafür?
Alkohol als Elektrophil
- saure Katalyse notwendig, damit Alkohol nicht als Säure reagiert
- Alkohol + Säure → Oxonium → Wasserabspaltung + Carbokation
- Carbokation reagiert mit Nu⊖ nach SN1
- Nu = Hal⊖, HSO4⊖, H2PO4⊖, NO3⊖

Welche Nomenklatur haben Ether?
Ether
Alkoxy- oder -ether
- Beite Alkylsubstituenten benennen
- Suffix -ether dazu
z.B. Ethylmethylether, Ethoxy-…, Butoxy-…, Methoxy-…

Welche Reaktionen können Amine einhergehen?
Reaktionen der Amine
- Als gute Base (Protonaufnahme) → mit Salpetriger Säure
- Als Nukleophil (ohne Deprotonierung im Vergleich zum Alkohol) → sekundäre, tertiäre, quartäre Amine
Welche Nomenklatur haben Amine?
Nomenklatur der Amine
-amin
- Position der Aminogruppe vor dem Suffix oder vor dem Alkan
- N-gebundene Alkylreste mit N kennzeichnen, anstatt Zahlen
- Substituenten alphabetisch anordnen
- Aminogruppe hat immer die kleinste Zahl

Benennen Sie folgende Verbindungen

- Ethylmethylether
- Diethylether
- Cyclohexyisopropylether
- 2-Methoxybutan
- 1-Ethoxy-3-methylpentan
Benennen Sie folgende Verbindungen

- 1,5-Pentadiol
- 2-Chloro-3-methylbutanol
Welche Nomenklatur haben Alkohole?
Nomenklatur der Alkohole
-ol (bei zwei oder mehr OH-Gruppen -diol, -triol,usw.)
- OH-Gruppe hat kleinste Zahl
- Wenn eine OH-Gruppe am Ende, keine 1
- Die Zahl entweder vor dem Suffix oder vor dem Alkanname
- Alphabetische Anordnung der Substituenten

Wie verläuft die Reaktion mit dem Amin als Base und welche Voraussetzungen dafür?
Amin als Base
mit Wasser
- Das Proton wird vom Amin aufgenommen → positive Ladung
mit Salpetriger Säure (HNO2)
- sekundäre Amine
- Salpetrige Säure dissoziiert in -NO+ (Nitrosonium-Ion) und -OH—
- SN1: freie Elektronen vom Stickstoff greifen Nitrosonium an, H2O spaltet ab → Nitrosamin als Produkt
- primäre Amine
- Salpetrige Säure dissoziiert in -NO+ (Nitrosonium-Ion) und -OH—
- SN1: freie Elektronen vom Stickstoff greifen Nitrosonium an, H2O spaltet ab → Diazonium-Salz als Produkt
Aminkationen sind stabiler als Carbokationen!!! →→ Ammonium-Salze werden bevorzugt

Wie können Nitrosamine hergestellt werden?
- Reaktion von sekundären Aminen
- als Base mit Salpetriger Säure (HNO2)
Verlauf der Reaktion
- Salpetrige Säure dissoziiert in -NO+ (Nitrosonium-Ion) und -OH—
- SN1: freie Elektronen vom Stickstoff greifen Nitrosonium an, H2O spaltet ab → Nitrosamin als Produkt
Aminkationen sind stabiler als Carbokationen!!! →→ Ammonium-Salze werden bevorzugt

Wie verläuft die Reaktion mit dem Amin als Nukleophil und welche Voraussetzungen dafür?
Amin als Nukleophil
- reaktiv gegenüber H3Cσ+— sprich Alkohole und Halogenalkane
- SN2, jedoch je größer die Amine (sec, tert usw.), desto wahrscheinlicher SN1
Aminkationen sind stabiler als Carbokationen!!! →→ Ammonium-Salze werden bevorzugt

Wie können sekundäre, tertiäre usw. Amine hergestellt werden?
- Amin als Nukleophil
- mit Alkoholen und Halogenalkanen
→ SN2, jedoch je größer die Amine (sec, tert usw.), desto wahrscheinlicher SN1

Wie werden Alkohole oxidiert?
Oxidation von Alkoholen
- primäre Alkohole
Alkohol → Aldehyd → Carbonsäure
- sekundäre Alkohole
Dehydrierung -H2 → Keton
- tertiäre Alkohole
nur Abbau

Wie können Ketone hergestellt werden?
Dehydrierung (-H2) von sekundären Alkoholen

Welche Reaktionen können Carbonyle einhergehen?
Carbonyle
- planar, weil sp2
— mit Elektrophilen (σ<span>-</span> am C)
— mit Nukleophilen (σ+ am C)
- Wenn Hydrid H– greift an → Alkohol
- Wenn Wasser greift an → Hydrat (2 -OH-Gruppen)
- Wenn Aldehyd greift an → Halbacetal
- Wenn Keton greift an → Halbketal
— als Enol (σ- am O)
— als Enolat

Wie können Alkohole hergestellt werden?
Reduktion von Ketonen und Aldehyden unter Katalysatoren (komplexe Hydride wie z.B. Lithiumaluminiumhydrid LiAlH4 oder Natriumborhydrid NaBH4 )

Wie werden Aldehyde und Ketone reduziert?
Reduktion von Aldehyden und Ketonen
→ Alkohole
- unter Katalysatoren (komplexe Hydride wie z.B. Lithiumaluminiumhydrid LiAlH4 oder Natriumborhydrid NaBH4 ): nukleophiler Angriff vom Hydrid H– → Alkoholat → Alkohol
- in der Biologie: NADH reduziert Keton (z.B. Pyruvat zu Lactat) durch Zufügung von H an σ+ von Carbonylgruppe und wird zu NAD+

Welche Nomenklatur haben Aldehyde?
Nomenklatur der Aldehyde
- -al, -aldehyd
- als Substituent: Formyl-

Benennen Sie folgende Verbindungen

- Methanal (Formaldehyd)
- Formylessigsäure (3-Oxopropansäure)
- Ethanal (Acetaldehyd)
Welche Nomenklatur haben Ketone?
Nomenklatur der Ketone
- Suffix: -on oder -keton
- Präfix: Oxo- oder Keto-

Benennen Sie folgende Verbindungen

- Propanon (Aceton)
- 2-Ketopropansäure (Pyruvat)
- 2-Ketoglutarat (β-Ketoglutarat, 2-Oxoglutarat, 2-Oxopentandisäure)
- 2-Ketobutan / 2-Oxobutan / Ethylmethylketon / 2-Butanon
Nennen Sie Produkte bei der nukleophilen Addition an Aldehyd folgende Verbindungen:
- Wasser
- Alkohol
- primäres Amin
- sekundäres Amin
- Hydrid
- CH-acide Verbindungen
Nukleophile Addition an Aldehyd
- +H2O → Hydrat (weitere Oxidation → Carbonsäure)
- +R-OH → Halbacetal (+R-OH + H+→ Acetal + H2O)
- +R-NH2 → Halbaminal + H+→ Imin
- +R-NH-NH2 → Halbaminal + H+→ Imin
- +H– → Alkohol
- +CH-acide → Aldol

Wie werden Halbacetale, bzw. Vollacetale hergestellt?
- Nukleophile Addition von Alkoholen an Aldehyde
- unter saurer Katalyse
→ Halbacetal → Acetal
Verlauf der Reaktion
- Freies e–-Paar vom Sauerstoff im Alkohol greift σ+ am C im Carbonyl an
- Die Doppelbindung klappt als freies e–-Paar hoch → negative Ladung
- Proton wird vom positiv geladenen Sauerstoff umgelagert
- Saure Katalyse protoniert OH-Gruppe
- Wasser wird abgespalten → Carbokation
- Carbokation reagiert mit dem weiteren Alkohol
- Unter H+-Abspaltung wird ein Acetal

Wie werden Halbketale, bzw. Vollketale hergestellt?
- Nukleophile Addition von Alkoholen an Ketone
- unter saurer Katalyse
→ Halbketal→ Ketal
Verlauf der Reaktion
- Freies e–-Paar vom Sauerstoff im Alkohol greift σ+ am C im Carbonyl an
- Die Doppelbindung klappt als freies e–-Paar hoch → negative Ladung
- Proton wird vom positiv geladenen Sauerstoff umgelagert
- Saure Katalyse protoniert OH-Gruppe
- Wasser wird abgespalten → Carbokation
- Weiter mit dem Alkohol reagiert
- H+ spaltet ab

Zeichnen Sie ein Halbacetal bzw. Halbketal. Was ist der Unterschied zu den Vollacetalen/Ketalen?

Wie werden Imine hergestellt?
Imine
- Aldehyd + R-NH2 → Halbaminal + H+→ Imin

Was ist Keto-Enol-Tautomerie? Wann werden Enole bevorzugt?
Keto-Enol-Tautomerie
- Wegen Azidität: Protonen am α-C-Atom der Carbonylgruppe werden leicht abgespalten (dann ensteht C=C und O–).
- Katalyse: basisch → H+ leicher abgespalten, mehr Enolat; sauer → Carbonylsauerstoff protoniert und extra polarisiert, mehr Enol
Normalerweise das Gleichgewicht auf der Seite des Ketons
Enole können aber stabilisiert werden:
– durch Konjugation der Doppelbindungen
– durch sterische Hinderung (Doppelbindung isoliert zwischen großen sterischen Gruppen)

Was sind Stereoisomere? Welche 2 große Gruppen gibt es innerhalb solcher Isomere? Nennen Sie jeweils ein Beispiel.
Stereoisomere
- Summenformel identisch
- Reihenfolge identisch
- räumliche Anordnung anders
- Konfigurationsisomere – unterscheiden sich in der räumlichen Anordnung, nicht in einander überführbar! (cis/trans) →→ Diastereomere, Enantiomere
- Konformationsisomere – unterscheiden sich nur in der Form, sind in einander überführbar (Cyclohexan: Sessel ↔Wanne)
Was sind Konstitutionsisomere? Nennen Sie zwei Beispiele.
Konstitutionsisomere
- Summenformel identisch
- Verknüpfungsreihenfolge unterschiedlich
Butan – Isobutan
Propan – Isopropan
Was sind Diastereomere? Wie unterscheiden sie sich von den Enantiomeren? Nennen Sie jeweils ein Beispiel.
Diastereomere
- Stereoisomere
- im Gegensatz zu Enantiomeren
- nicht wie Bild und Spiegelbild
- ein Stereozentrum muss identisch sein, ansonsten Enantiomerie!
- wenn nur ein Stereozentrum anders – Epimere (D-Glucose und D-Galactose)
- physikalische Unterschiede (Schmelzpunkt, Siedepunkt, Löslichkeit, NMR-Spektrum, IR-Spektrum usw.)
- chemischen Eigenschaften
(Beispiel: die Zucker D-Glucose und L-Galactose, die sich in drei von vier Stereozentren unterscheiden)

Was sind Enantiomere? Nennen Sie ein Beispiel.
Enantiomere
- Bild und Spiegelbild
- können nicht durch Drehung in einander überführt werden
- chemische und physikalische Eigenschaften gleich, außer optischer Aktivität
+ rechsdrehend
- linksdrehend
Konfigurationen:
R (D) – rectus = rechts
S (L) – sinister = links
Beispiel:
D-Glucose und L-Glucose

Nennen Sie 2 Gruppen der Konfigurationsisomere mit jeweils einem Beispiel.
Konfigurationsisomere
- unterschiedliche räumliche Anordnung
- nicht in einander überführbar
Diastereoisomere (mind. 1 Zentrum gleich, nicht Bild/Spiegelbild) – D-Glucose und L-Galactose
Enantiomere (Bild/Spiegelbild) – D-Glucose und L-Glucose

Welche Untergruppen von Diastereomeren gibt es? Jeweils ein Beispiel dazu.
Diastereomere
Konfigurationsisomere, mindestens in einem Stereozentrum unterschiedlich
- Wenn nur in einem – Epimere (D-Glucose und D-Galactose)
- Wenn Epimere in einem anomeren Kohlenstoff unterscheiden – Anomere (β-D-Glucopyranose und α-D-Glucopyranose)
- Wenn alles andere – cis/trans oder E/Z (entgegen=trans/zusammen=cis)
Benennen Sie folgende Verbindungen:

- Propan
- n-Propyl
- i-Propyl = iPr= Isopropyl-
- n-Butan
- Isobutan
- n-Butyl
- i-Butyl = iBu = Isobutyl-
- tert.-Butyl = tBu = tertiär Butyl-
- Neopentyl-
- n-Pentan
- Neopentan
- Isopentan
Benennen Sie folgende Verbindungen:

- 4-Ethyl-3-methylheptan
- 3,5-Dimethyloctan
- 1,2-Dimethylcyclopentan
- 3-Isopropylpentan, 3-(1’-Methylethyl)pentan, 3-Ethyl-2-methylpentan
- Isopropanol
- Neopentylbromid
Welche Reaktionen können Alkane einhergehen?
Alkane
- reaktionsträg: vor der Reaktion ist eine Spaltung notwenig → heterolytisch (Ionenbildung) oder homolytisch (Radikalenbildung)
- radikalische Substitution SR
- nukleophile Substitution SN
Was ist die radikalische Substitution SR?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
radikalische Substitution SR
- Alkane mit Halogenradikalen
- → Halogenalkane werden hergestellt
- thermodynamisch kontrolliert bei 25° (primäre Radikale instabiler und reagieren schneller → mehr Verbindungen, stammend aus sekundären/tertiären Radikalen, etwa höher substituerte) oder kinetisch kontrolliert bei 600° (niedriger substituierte Verbindungen haben an Enden einfach mehr Stellen für Substitution → statistisch bestimmt)
- Fluor zu reaktiv, Chlor ok, Brom nur bei schwachen R-H (bilden sek./tert. Radikale besser)
- Start: Halogene werden homolytisch in Radikale gespalten
- Ein Halogenradikal reagiert mit dem Alkan (Verbindung zum H wird angegriffen)
- Es ensteht ein Alkan-Radikal, der mit dem molekularen Halogen reagiert
- Dann ensteht wieder ein Halogenradikal usw.

Wann ist die radikalische Substitution SR der Alkanen thermodynamisch oder kinetisch kontrolliert und warum?
Radikalische Substitution SR bei Alkanen
- thermodynamisch kontrolliert bei 25° (primäre Radikale instabiler und reagieren schneller → mehr Verbindungen, stammend aus sekundären/tertiären Radikalen, etwa höher substituerte Verbindungen)
- kinetisch kontrolliert bei 600° (niedriger substituierte Verbindungen haben an Enden einfach mehr Stellen für Substitution → statistisch bestimmt, weil bei höheren Temperaturen keine Rolle spielt)
Was ist der induktive Effekt? Welche Auswirkungen hat er auf die Reaktionsfähigkeit?
Induktiver Effekt (I-Effekt)
e– werden vom elektronegativeren Partner hingezogen
+I-Effekt („elektronenschiebend“)
- geringere Elektronegativität als C
- Anionen/Metalle/-CH3 (Hybridorbitale, je länger die Kette → stärker)
- Abspaltung eines Protons erschwert (Säurestärke ist geringer)
- SEAr: ortho- oder para- (e– ins System hineingeschoben)
- Radikale und Carbokationen stabilisiert
−I-Effekt („elektronenziehend“)
- höhere Elektronegativität als C
- O, N, Halogene, Kationen, sp2 und sp-Kohlenstoffe
- Abspaltung eines Protons erleichtert (Säurestärke ist entsprechend groß)
- Radikale und Carbokationen destabilisiert
(CH3)3C- < (CH3)2CH- < -C2H5 < -CH3 < -H < -C6H5 < -CH3O < -OH < -I < -Br < -Cl < -NO2< -F
–I:
- NR3+< -OR2+ (Zahl der Substituenten wichtig)
- C=CR < -Ph < -C≡CR
- NR2 < -OR < -F
- NR2 < =NR < ≡N
Was ist nukleophile Substitution SN?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
nukleophile Substitution SN
- Halogenalkane reagieren mit Nukleophilen
- je nach Nukleophil (stark/schwach) werden H_alogenalkane, Alkohole, Ether, Amine und Thiole_ hergestellt
- SN1:
- SN2:
- Konkurrierend: Eliminierung
Wie verläuft die nukleophile Substitution nach SN1-Mechanismus?
- Welche Bedingungen begünstigen die Reaktion?
Nukleophile Substitution SN1 (unimolekular)
- 2 Schritte: Bildung des Carbokations und Racemisierung
Begünstigt durch:
– polare protische Lösungen (stabilisieren Carbokationen)
— große Substituenten
— +I-Effekte: Carbokation stabilisiert
— “schlechte” Nukleophile: klein, nicht so agressiv
— “gute” Abgangsgruppen: schwache Basen wie R-I, R-Br, R-Cl
- Dissoziation in Ionen → Carbokation wird gebildet (planar)
- Nu⊖ greift von beiden Seiten an → Racemat 1:1

Wie verläuft die nukleophile Substitution nach SN2-Mechanismus?
- Welche Bedingungen begünstigen die Reaktion?
nukleophile Substitution nach SN2-Mechanismus (bimolekular)8
- 1 Schritt, “Waldensche Umkehr”
- Inversion der Konfiguration am C (gegenüber der Abgangsgruppe)
Begünstigt durch:
— aprotische Lösungen: “nackte” Nukleophile ohne Wasserstoffbrücken (DMSO)
— –I-Effekte: Carbokation instabil
— “gute” Nukleophile: groß
— kleine Abgangsgruppen: einfaches Umklappen
— “schlechte” Abgangsgruppen: starke Basen wie -NH2, -OH usw.
Mechanismus:
- Der Nu greift gegenüber der Abgansgruppe an

Nennen Sie die Regel, die bei der Nomenklatur von Alkenen/Alkinen zu beachten sind.
Nomenklatur Alkene/Alkine
- Die längste Kette auswählen
- Doppelbindung bekommt kleinste Nummer (-en, -dien, -trien, -enin)
- Wenn Doppelbindung in der Mitte — Verzweigung hat kleinste Nummer
- Viele Doppelbindungen — ab dem Ende zählen, wo am nähesten DBs
- Wenn Doppel- und Dreifachbindungen: DB hat kleinste Nummer
Wie verläuft die Eliminierung nach E1-Mechanismus?
- Was reagiert und was entsteht?
- Welche Bedingungen begünstigen die Reaktion?
Eliminierung nach E1-Mechanismus
- Alkohole oder Halogenalkane
- 2 Schritte: Dissoziation + Angriff von der Base
- SN1-Konkurrenz
begünstigt durch:
— schwache Nu
— harte, schwache und sehr große Basen (H besser zugänglich)
— protische Lösungen
— +I-Effekte
Mechanismus:
- Entstehung des Carbokations (Abgansgruppe dissoziiert)
- H am zweiten C-Atom (vom C, wo + entsteht) wird von der Base angegriffen
- Doppelbindung entsteht → Markownikow-Regel beachten (höher substituierte Verbindungen bevorzugt, weil stabiler)

Wie verläuft die Eliminierung nach E2-Mechanismus?
- Was reagiert und was entsteht?
- Welche Bedingungen begünstigen die Reaktion?
Eliminierung nach E2-Mechanismus
- 1 Schritt: nicht isolierbares Zwischenprodukt
- antiperiplanare Konfiguration von H und X (Base greift H gegenüber dem X), wenn Cyclohexane – nur axial
begünstigt durch:
— starke, harte und große Basen (H besser zugänglich)
— Stabilität der Kationen einfach beachten (für E2 sollten sie instabiler sein)
— höhere t°
Mechanismus:
- Base greift das H an, das gegenüber dem X steht (antiperiplanar)
- Zwischenprodukt, wo Base an H “hängt”
- BH und X-
- Alken entsteht

Was ist saure Dehydratisierung von Alkoholen?
- Was reagiert und wie?
- Was entsteht?
- Welche konkurrierende Reaktionen gibt es?
saure Dehydratisierung von Alkoholen
- Alkohole mit Base, Katalysator - Säure
- zuerst saure Katalyse → H2O-Abspaltung → Carbokation
- je nach Temperatur laufen unterschiedliche Mechanismen ab:
130°: Nukleophile Substitution → Alkohol reagiert mit sich selbst (Alkohol als Base) → Ether
180°: Eliminierung → Base greift H gegenüber der Ladung am Carbokation an → Alken

Wie können Halogenalkane hergestellt werden?
Halogenalkane können mittels
- radikalische Substitution
- elektrophile Addition
hergestellt werden
Was ist die Aldolkondensation/Aldoladdition?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
Aldolkondensation/Aldoladdition
- Aldehyd/Keton mit sich selbst unter basischer Katalyse
- → β-Hydroxyaldehyden (Aldole) oder β-Hydroxyketonen
- Kondensation → α,β-ungesättigter Aldehyd
- Standard: 2 x Acetaldehyd → 3-Hydroxybutanal → ,,,
Mechanismus:
- Deprotonierung durch Base → mehr Enolat
- Nukleophiler Angriff vom Enolat → Alkoholat
- Protonierung → 3-Hydroxyaldehyd (Aldol)
- Kondensation (-H2O) → konj. π-System

Welche Verbindungen haben schwache Carbonylaktivität und warum?
schwache Carbonylaktivität
- stabilisiert durch Mesomerie (Carboxylat)
- stabilisiert durch positive Ladung (Carbonsäure)

Welche Verbindungen haben starke Carbonylaktivität und warum?
starke Carbonylaktivität
- –I-Effekt (Halogene)
- Anhydride
- Ketone/Aldehyde

Wie können Ester hergestellt werden?
Herstellung von Estern
- Veresterung von Carbonsäuren
- Alkohol reagiert mit der Carbonsäure
- Durch Säure wird -OH protoniert → positiv geladen (aktiviert für nukleophile Angriffe)
- O vom Alkohol greift σ– am C an
- Protonenshift → H2O abgespalten
- Proton abgespalten

Wie funktioniert die Veresterung von Carbonsäuren?
Veresterung von Carbonsäuren
- Alkohol reagiert mit der Carbonsäure
- Ester ist das Endprodukt
- Durch Säure wird -OH protoniert → positiv geladen (aktiviert für nukleophile Angriffe)
- O vom Alkohol greift σ– am C an
- Protonenshift (Tautomerie) → H2O abgespalten (Kondensation)
- Proton abgespalten (Deprotonierung)

Benennen Sie folgende Verbindungen

- N*-Methylmethan-säureamid
- N,N*-Dimethylmethan-säureamid
Können die Carbonsäureamide aus einfachen Carbonsäuren und Aminen hergestellt werden?
Nein, da die Carbonsäure das basische Amin protoniert → Verlust der Nukleophilie
- geht nur mit Carbonsäurenchloriden/Anhydriden

Wie können Carbonsäureamiden hergestellt werden?
Carbonsäureamide
- geht nur mit Carbonsäurenchloriden/Anhydriden + Aminen
- einfache Carbonsäure protoniert das basische Amin → Verlust der Nukleophilie

Wie verläuft Claisenkondensation?
- Was reagiert?
- Wie katalysiert?
- Was entsteht?
- Was ist der Mechanismus?
Claisenkondensation
- Ester mit dem Ester → β-Ketocarbonsäureester (acyliert)
- Standard: Ethylacetat x2 → Acetessigsäureethylester
- basisch katalysiert (mit Ethanol)
Mechanismus:
- Deprotonierung durch Base am aziden Kohlenstoff
- Nukleophiler Angriff
- Et-OH spaltet ab

Was ist Vinylogieprinzip? Warum ist es wichtig?
Vinylogieprinzip
- Mesomerie zwischen C-C und C=O → nicht nur der Carbonyl-Kohlenstoff positiv polarisiert sondern auch C am β-Position positiv polarisiert
- begünstigt H2O-Abspaltung
- bei Michael-Addition

Wie verläuft Michael-Addition?
- Welche Verbindungen reagieren?
- Was wird hergestellt?
- Welche Bedingungen begünstigen die Reaktion?
- Gibt es konkurrierende Reaktionen?
Michael-Addition
- vinyloge Verbindungen (α,β-ungesättigte Carbonylverbindungen)
- Nukleophile Addition am Cβ
- basisch katalysiert (O– protoniert und Doppelbindung zum O regeneriert)

Wie verläuft Friedel-Crafts-Acylierung?
- Was reagiert?
- Wie katalysiert?
- Was entsteht?
- Was ist der Mechanismus?
Friedel-Crafts-Acylierung
- Aromat mit dem Acylium-Ion R-C+=O
- AlCl3 katalysiert
- Elektrophilearomatische Substitution SE
- AlCl3 kann Komplexe bilden → kleine Mengen
Mechanismus
- AlCl3 macht Acylium-Ion aus den Carbonsäurechloriden

Warum ist Ammoniak toxisch?
- Ammoniak NH3 hat ein freies Elektronenpaar → Nukleophil
- wird in Harnstoff umgewandelt, der mesomeriestabilisiert ist

Wie sieht die funktionelle Gruppe Lacton aus?
Lacton
cyclische Ester

Wie sieht die funktionelle Gruppe Lactam aus?
Lactam
cyclische Amide

Zeichnen Sie Benzoesäure
Benzoesäure
auch Benzencarbonsäure

Wie lautet die Oxidationszahl des Kohlenstoffs im Harnstoff?
+4

Wie sieht ein Guanidinium-Ion aus?
Guanidinium-Ion
+4

Wie sieht ein Nukleosiddiphosphat aus?
Nukleosidphosphat

Wie sieht Kohlensäure aus?
Kohlensäure

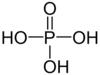
Wie sieht Phosphorsäure aus?
Phosphorsäure
Welche Lipide sind hydrolisierbar?
Hydrolisierbare Lipide
- Esterbindung
- fast keine Heteroatomen
→ durch Esterasen spaltbar
Welche Lipide aus der Liste sind hydrolisierbar? Benennen Sie und bezeichnen Sie die hydrolisierbare Stellen.


Zeichnen Sie Glycerol.
Glycerol

Wie aggreggieren sich folgende Lipide im Wasser:

Aggregation
- “ein Schwanz” → Micellen
- “zwei Schwänze” → Liposomen (Lipiddoppelschichten)
Was sind heutzutage Kohlenhydrate?
Kohlenhydrate
-
Polyhydroxy-Aldehyde (Aldosen) oder Polyhydroxy-Ketone
(Ketosen) - liegen als entsprechende cyclische (Halb-)Acetale bzw. (Halb-)Ketale vor
Wie sieht ein Molekül der Galaktose aus?
Galaktose

Wie sieht ein Molekül der Mannose aus?
Mannose

Wie sieht ein Molekül der Fruktose aus?
Fruktose

Welche Reaktionen können Aldosen einhergehen?
Reaktionen der Aldosen
- Zyklisierung zu Halbacetalen
- Oxidation
- Leicht: Aldehyd zur Carbonsäure, bzw. Halbacetal zum Lacton
- schwache Oxidationsmittel genügen (Cu2+, Ag+)
- Schwer: primärer Alkohol zu Carbonsäure, immer über Aldehyd
- Carbonylreaktionen (z.B. mit Aminen oder Hydrazinen)
- Veretherung mit anderen Alkoholen und Acetalbildung (Glykoside)
- Veresterung mit Carbonsäuren und Mineralsäuren
Was passiert, wenn D-Glucose mit dem Wasser und Diaminesilber(I)-Komplex [Ag(NH3)2] gemischt wird?
Das gilt als Nachweis von reduzierenden Zuckern (freie Aldehydgruppen) mit sogenannter Tollensprobe.
Das Tollensreagenz ist eine ammoniakalische Silbernitrat-Lösung. Der Nachweis ist positiv, wenn Ag fällt → Silberspiegel an der Reagenzglaswand.
Obwohl die offenkettige Form (Aldehyd) dieser Zucker in wässriger Lösung nur in sehr geringem Anteil neben den geschlossenen Ringformen (hier ist die Aldehydgruppe als Halbacetal gebunden) vorliegt, läuft die Reaktion dennoch praktisch vollständig ab, da die offenkettige Form über ein chemisches Gleichgewicht aus den Ringformen nachgebildet wird.

Was sind Glykoside? Nennen Sie ein Beispiel.
Glykoside
Verbindungen mit einem Rest am anomeren Kohlenstoffatom (statt –OH) eines Monosaccharids
Häufigster Fall: Monosaccharid + Alkohol → Vollacetal/-ketal

Wie sieht Nucleosiddiphosphat (NDP) aus? Welche Art der Bindung existiert zwischen Diphosphaten und Ribose?
Nucleosiddiphosphat (NDP)

Was ist der Unterschied zwischen Peptiden und Proteinen?
beide sind Polyamide
Peptide <100 AS
Proteine >100 AS
Warum hat jede Aminosäure mindestens 2 pKs-Werte?
-COOH und -NH2 können geladen werden
- sauer — maximal protoniert (NH3+)
- basisch — maximal deprotoniert (COO–)

Was ist ein isoelektrischer Punkt?
Isoelektrischer Punkt
- Der pH Wert, bei dem eine Aminosäure oder ein Peptid eine Nettoladung von null hat
- Er ist von den pKs-Werten der einzelnen funktionellen Gruppen abhängig und für jede Aminosäure eine charakteristische Konstante
- Bei diesem pH-Wert wandert die Aminosäure nicht im elektrischen Feld
- Der pI ist das arithmetische Mittel der pKs-Werte
Wie viele Tripeptide kann man aus diesen drei Aminosäuren machen, wenn einzelne Aminosäuren auch mehrfach vorkommen können ?
Allgemein ist die Zahl der möglichen Konstitutionsisomere = n!

Warum ist Amidgruppe besonders? Welche Konsequenzen hat das?
Amidgruppe
- Aminogruppe bewirkt einen +M-Effekt am Carbonyl C,
- Sauerstoff bewirkt einen -M-Effekt am Carbonyl C
Konsequenz
- Partielle Ladung am Sauerstoff, starker Elektronenpaardonator
- Partiell positive Ladung am Stickstoff, erhöhte Azidität des Wasserstoffs
- Behinderte Rotation um die Amidbindung, partieller Doppelbindungscharakter



